题目内容
下列溶液中,Cl-的物质的量浓度与50mL1mol/LAlCl3溶液中Cl-物质的量浓度相等是( )
| A、100mL3mol/LKClO3溶液 |
| B、75mL2.5mol/LMgCl2溶液 |
| C、150mL3mol/LKCl溶液 |
| D、25mL2mol/LAlCl3溶液 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:根据溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算氯离子的物质的量浓度,与溶液的体积无关,50ml 1mol/LAlCl3溶液中Cl-物质的量浓度为3mol/L.
解答:
解:A、100mL3mol/LKClO3溶液中无氯离子存在,故A错误;
B、75ml 2.5mol/LMgCl2溶液中氯离子的物质的量浓度是=2.5mol/L×2=5mol/L,故B错误;
C、150mL3mol/LKCl溶液中氯离子的物质的量浓度是=3mol/L×1=3mol/L,故C正确;
D、25mL2mol/LAlCl3溶液中氯离子的物质的量浓度是=2mol/L×3=6mol/L,故D错误.
故选:C.
B、75ml 2.5mol/LMgCl2溶液中氯离子的物质的量浓度是=2.5mol/L×2=5mol/L,故B错误;
C、150mL3mol/LKCl溶液中氯离子的物质的量浓度是=3mol/L×1=3mol/L,故C正确;
D、25mL2mol/LAlCl3溶液中氯离子的物质的量浓度是=2mol/L×3=6mol/L,故D错误.
故选:C.
点评:本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
相关题目
当0.2molNa2O2足量CO2完全反应后所得固体的质量为( )
| A、21.2g |
| B、21.6g |
| C、22.0g |
| D、22.4g |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、17gNH3所含质子数目为7 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,1 NA 个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5mol?/L的MgCl2溶液中,含有Cl- 个数为1 NA |
X、Y、Z、R为前四周期元素且原子序数依次增大.X的单质与氢气可以化合生成气体G,可使湿润的红色石蕊试纸变蓝;Y单质是一种黄色固体;R是一种应用最广的金属,它的一种含氧酸根化学式为RO42-,且具有强氧化性.Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L.则下列说法不正确的是( )
| A、R在元素周期表中位置为第四周期VIII族 |
| B、Na2RO4水溶液可以用于杀菌消毒和净水 |
| C、1molY或Z与足量的R反应均转移2mol电子 |
| D、G为极性分子,中心原子采取sp2杂化 |
有关性质或反应的离子方程式表示不正确的是( )
| A、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
| B、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| C、向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2═Al(OH)3↓+HCO3- |
| D、在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3═2FeO42-+3Cl-+5H2O |
下列分子中,各原子处于同一平面的是( )
| A、CH2O |
| B、NH3 |
| C、CCl4 |
| D、PCl3 |
下列两种气体的原子数一定相等的是( )
| A、质量相等、密度不等的N2和C2H4 |
| B、等体积等密度的CO和N2 |
| C、等温等体积的O2和Cl2 |
| D、等压等体积的NH3和CO2 |
 氯气是一种化学性质活泼的气体.
氯气是一种化学性质活泼的气体.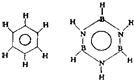 巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )
巳知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为( )