题目内容
在一固定体积的密闭容器中,可逆反应,nA(g)+mB (g)?pC(g)已经达到平衡状态.已知n+m>p,正反应为放热反应.下列分析结论中正确的是( )
①升温,
的值变小;
②降温,平衡体系内混合气体的平均相对分子质量变小;
③增加B的物质的量,A的转化率增大;
④使用催化剂,气体总的物质的量不变;
⑤加压使密闭容器的容积变小,A或B的浓度则变大;
⑥若A的反应速率为v(A),则v(B)=
[v(A)].
①升温,
| c(B) |
| c(C) |
②降温,平衡体系内混合气体的平均相对分子质量变小;
③增加B的物质的量,A的转化率增大;
④使用催化剂,气体总的物质的量不变;
⑤加压使密闭容器的容积变小,A或B的浓度则变大;
⑥若A的反应速率为v(A),则v(B)=
| n |
| m |
| A、①② | B、②③④ |
| C、③④⑤ | D、③④⑥ |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:①该反应为吸热反应,升温,平衡正向移动;
②降温时平衡逆向移动,结合M=
分析;
③加入B,平衡正向移动,促进A的转化;
④加入催化剂,平衡不移动;
⑤于增大压强,平衡正向进行,新平衡状态下AB物质的量增大;
⑥速率之比等于化学方程式计量数之比;
②降温时平衡逆向移动,结合M=
| m |
| n |
③加入B,平衡正向移动,促进A的转化;
④加入催化剂,平衡不移动;
⑤于增大压强,平衡正向进行,新平衡状态下AB物质的量增大;
⑥速率之比等于化学方程式计量数之比;
解答:
解:①该反应为放热反应,升温,平衡逆向移动,B增多,C减小,所以c(B)/c(C)的比值增大,故①错误;
②降温时平衡正向移动,由M=
可知,气体质量不变,总物质的量减小,则混合气体平均相对分子质量变大,故②错误;
③加入B,平衡正向移动,促进A的转化,所以A的转化率增大,故③正确;
④加入催化剂,平衡不移动,气体总的物质的量不变,故④正确;
⑤增大压强,平衡正向进行,但A、B的浓度比原状态大,故⑤正确;
⑥若A的反应速率为v(A),则v(B)=
[v(A)],故⑥错误;
故选C.
②降温时平衡正向移动,由M=
| m |
| n |
③加入B,平衡正向移动,促进A的转化,所以A的转化率增大,故③正确;
④加入催化剂,平衡不移动,气体总的物质的量不变,故④正确;
⑤增大压强,平衡正向进行,但A、B的浓度比原状态大,故⑤正确;
⑥若A的反应速率为v(A),则v(B)=
| m |
| n |
故选C.
点评:本题考查化学平衡的影响因素,把握反应的特点及平衡移动的常见影响因素为解答的关键,⑤为解答的难点和易错点,注重基础知识的考查,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4溶液;电源有a、b两极.若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,实验现象如图所示,下列说法正确的是( )


| A、电源中a为正极,b为负极 |
| B、试管A中的电极反应式为:2H++2e-=H2↑ |
| C、一段时间后滤纸条上紫红色向C处移动 |
| D、电解一段时间后,切断K2、K3,闭合K1,电流计的指针会发生偏转 |
下列叙述正确的是( )
| A、.将73gHCl溶于水中配成1L溶液?所得溶液物质的量浓度是2mol/L | ||||
B、.在反应2CO+O2
| ||||
| C、.在标准状况下,1mol任何物质的体积都约为22.4L | ||||
| D、?标准状况下1.8L H2O和1.8L NH3所含分子个数相同 |
所有同系物都具有( )
| A、相同的相对分子质量 |
| B、相同的物理性质 |
| C、相似的化学性质 |
| D、相同的最简式 |
T℃时,将NO2和N2O4的混合气体通入容积不变的密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.各组分的浓度随时间的变化如图.下列说法正确的是( )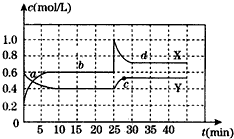

| A、第35min时,NO2的体积分数高于第15min时的体积分数 |
| B、T℃时,N2O4(g)?2NO2(g)的平衡常数为0.9 |
| C、a、b、C、d四点中,气体颜色最浅的是C点 |
| D、0~10min内反应体系对外界放热,25~30min内反应体系从外界吸热 |
关于强、弱电解质的叙述不正确的是( )
| A、强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| B、同一弱电解质溶液,温度不同时,导电能力不同 |
| C、强电解质在溶液中完全电离,但溶液中存在电离平衡 |
| D、强电解质在固态或液态时,可能不导电 |