题目内容
11.铝被还原的反应是( )| A. | Al与Fe2O3 | |
| B. | 电解熔融Al2O3 | |
| C. | 除去Al2O3的铝条浸在Hg(NO3)2溶液中 | |
| D. | A1与稀HCl |
分析 铝元素在反应中化合价降低,发生还原的反应,由此分析解答.
解答 解:A、Al与Fe2O3生成氧化铝和单质铁,铝元素化合价升高,故A错误;
B、电解熔融Al2O3生成单质铝,铝元素化合降低,被还原的反应,故B正确;
C、除去Al2O3的铝条浸在Hg(NO3)2溶液中,发生置换反应铝的化合升高,发生氧化反应,故C错误;
D、A1与稀HCl生成氯化铝和氢气,铝元素的化合升高发生氧化反应,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答关键,侧重氧化还原反应判断的考查,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
1.下列化学用语的书写,正确的是( )
| A. | 氮气的电子式: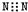 | B. | 硫原子的结构示意图: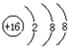 | ||
| C. | 溴化钠的电子式: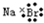 | D. | 质量数为37的氯原子${\;}_{17}^{37}$Cl |
2.向明矾溶液中滴入氢氧化钡溶液,当SO42-沉淀完全时,铝元素的存在形式是( )
| A. | Al(OH)3 和Al3+ | B. | Al(OH)3 和AlO2- | C. | 全部为Al(OH)3 | D. | 全部为AlO2- |
19.下列有关丙烯醛( CH2=CH-CHO)的叙述中,不正确的是( )
| A. | 可使溴水溶液褪色 | B. | 不能与酸性高锰酸钾溶液反应 | ||
| C. | 能发生银镜反应 | D. | 一定条件下能发生加聚反应 |
6.清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG).其主要成分都是( )
| A. | 氢气 | B. | 碳水化合物 | C. | 碳氢化合物 | D. | 醇类 |
16.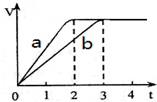 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )| A. | 曲线a代表Al的反应过程,曲线b代表Mg的反应过程 | |
| B. | Mg和Al的质量之比为3:2 | |
| C. | Mg和Al的物质的量之比为3:2 | |
| D. | Mg和Al的反应速率之比为3:2 |
3.解放日报12月13日报道,甘肃发现亿吨级大油田,石油是一种重要的能源.下列关于石油的说法正确的是( )
| A. | 石油不溶于水密度比水大 | B. | 石油中主要含有碳、氢两种元素 | ||
| C. | 石油的裂化属于物理变化 | D. | 石油分馏获得的各馏分是纯净物 |
20.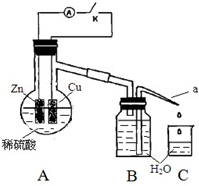 某同学分析Zn 与稀H2SO4的反应.
某同学分析Zn 与稀H2SO4的反应.
(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)═ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol 则Zn 与稀H2SO4反应生成1mol H2时的反应热△H=kJ/mol.
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K 开始,每间隔1 分钟,交替断开或闭合K,并连续计数每1 分钟内从a 管流出的水滴数,得到的水滴数如下表所示:
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K 时比断开K 时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K 时的反应速率快于闭合K 时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112 的主要原因是断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
 某同学分析Zn 与稀H2SO4的反应.
某同学分析Zn 与稀H2SO4的反应.(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)═ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol 则Zn 与稀H2SO4反应生成1mol H2时的反应热△H=kJ/mol.
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K 开始,每间隔1 分钟,交替断开或闭合K,并连续计数每1 分钟内从a 管流出的水滴数,得到的水滴数如下表所示:
| 1 分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1 分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K 时比断开K 时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K 时的反应速率快于闭合K 时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112 的主要原因是断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
19.下列事实不能用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 加入催化剂有利于氨的氧化反应 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |