题目内容
16.水是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,为了探究水质优劣,某综合实验小组来自来水厂参观,了解到源水处理成自来水的工艺流程示意图如图1所示: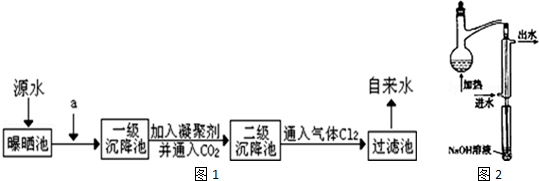
提供的试剂:饱和K2CO3溶液、NaOH溶液、Ba(NO3)2溶液、75%的乙醇、生石灰、CCl4、BaCl2溶液
(1)天然水中溶解的气体主要有氧气、二氧化碳(或氮气).硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,则此水的硬度为10°.
(2)为除去源水中含有Ca2+、Mg2+、HCO3-、Cl-、SO42-等离子,选出a所代表的试剂,按加入的顺序依次为BaCl2、CaO(只填化学式).
(3)天然水在净化处理过程中加入的混凝剂可以是明矾或硫酸铁等,其净水作用的原理是Al3++3H2O?Al(OH)3+3H+或Fe3++3H2O?Fe(OH)3+3H+,水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的.
(4)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属配离子M(CN)mn的形式存在于水中.测定污水中含氰化合物含量的实验步骤如下:
Ⅰ.水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收.
Ⅱ.滴定:将吸收液调节至pH>ll.以“试银灵”作指示剂,用AgNO3标准溶液滴定,终点时溶液由黄色变成橙红色,反应的离子方程式为:Ag++2CN-═[Ag(CN)2]-.
根据以上知识回答下列问题.①水样预处理的目的是将含氰化合物全部转化为CN-.
②水样预处理的装置如图2所示,细导管插入吸收液中的目的是充分吸收HCN,防止有毒气体排放到空气中.
蒸馏瓶比吸收液面要高,其原因是防止倒吸.
分析 源水在曝晒池中一段时间后,加入试剂a为氯化钡溶液,利用钡离子除去硫酸根离子,再利用碱除去Ca2+、Mg2+、HCO3-,所以a代表的试剂及加入顺序为BaCl2、CaO,一级沉降池后加入混凝剂可以是明矾、硫酸铝、硫酸铁、硫酸亚铁等,产生胶体吸附水中悬浮杂质,进行二级沉降池,再通入气体氯气消毒杀菌在过滤池中分离得到自来水,
(1)水中溶解少量的空气;硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(2)利用钡离子除去硫酸根离子,再利用碱除去Ca2+、Mg2+、HCO3-;
(3)加入的混凝剂可以是明矾、硫酸铝、硫酸铁、硫酸亚铁,产生胶体吸附水中悬浮杂质;
(4)①含氰化合物的污水处理过程需要用氢氧化钠将含氰化合物全部转化为HCN;
②为了保证生成的HCN全部被吸收,导气管要深入NaOH溶液中;但将导气管伸入NaOH溶液中有可能引起倒吸,所以将烧瓶位置挂高.
解答 解:(1)天然水中溶解的气体主要有氧气、二氧化碳(或氮气);某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=$\frac{67.2mg}{10}$+$\frac{24mg}{7.1mg}$=10,
故答案为:氧气;二氧化碳(或氮气);10°;
(2)钡离子除去硫酸根离子,再利用碱除去Ca2+、Mg2+、HCO3-,且过量的钡离子能被碳酸根离子除去,所以a代表的试剂及加入顺序为BaCl2、CaO,
故答案为:BaCl2、CaO;
(3)加入的混凝剂可以是明矾、硫酸铝、硫酸铁、硫酸亚铁等,产生胶体吸附水中悬浮杂质,净水原理用离子方程式可表示为Al3++3H2O?Al(OH)3+3H+或Fe3++3H2O?Fe(OH)3+3H+或Fe2++2H2O?Fe(OH)2+2H+,
故答案为:明矾或硫酸铁等;Al3++3H2O?Al(OH)3+3H+或Fe3++3H2O?Fe(OH)3+3H+,水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的;
(4)①根据题给信息,污水预处理的目的是将各种形态含氰化合物转化为可以测定的HCN,所以水样预处理的目的是将含氰化合物全部转化为CN-,
故答案为:将含氰化合物全部转化为CN-;
②为了保证生成的HCN全部被吸收,导气管要深入NaOH溶液中,将导气管伸入NaOH溶液中有可能引起倒吸,所以将烧瓶位置挂高,使得蒸馏瓶比吸收液面要高出很多,
故答案为:充分吸收HCN,防止有毒气体排放到空气中;防止倒吸.
点评 本题考查较综合,涉及物质含量的测定、盐类水解的应用、净水方法和软化原理、水的硬度计算及氧化还原反应等,把握题干信息及知识迁移应用为解答的关键,侧重分析与计算的考查,题目难度中等.

 金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.下列有关绿原酸的说法中不正确的是( )
金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.下列有关绿原酸的说法中不正确的是( )| A. | 绿原酸分子中有4个手性碳原子(碳旁边连接4个不同的原子或原子团) | |
| B. | 绿原酸能发生显色反应、取代反应和加成反应 | |
| C. | 每摩尔绿原酸最多与4 mol NaOH反应 | |
| D. | 绿原酸分子中所有碳原子都能在同一平面上 |
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氰化物的稳定性庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物对应水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
| A. | 苯与溴水在铁做催化剂的作用下可以发生取代反应 | |
| B. | 甲烷和苯都既能发生取代反应,又能使酸性KMnO4溶液褪色 | |
| C. | 乙醇和乙酸分子中都含羟基,都既能与Na反应,又能与NaOH溶液反应 | |
| D. | 甲苯可与浓硝酸在一定条件下发生取代反应 |
| A. | 镁条镁粉 | B. | 氧化钠过氧化钠 | C. | 氕氘氚 | D. | C60石墨 |
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)若V4=10.0,V5=6.0,则实验①、③可探究浓度对反应速率的影响.