题目内容
3.化学反应中伴随能量变化,如图是两反应能量变化示意图.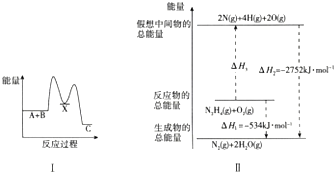
(1)反应A+B→C(△H)分两步进行:①A+B→X(△H1),②X→C(△H2)总反应过程中能量变化示意图如图Ⅰ所示.△H<(填“>”或“<”)0,△H1>0,△H2<0.
(2)肼(N2H4)是一种高能燃料,有关化学反应的能量变化如图Ⅱ所示.已知:断裂1mol化学键所需的能量:N≡N为942kJ、O=O为500kJ、N-N为154kJ,断裂1molN-H键所需的能量是391kJ.
分析 (1)根据图象结合反应物总能量大于生成物总能量时,该反应为放热反应即△H<0,反应物总能量小于生成物总能量时,该反应为吸热反应即△H>0判断;
(2)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),即断裂1molN-N键、4molN-H键和1molO=O键共吸收2752kJ-534kJ=2218kJ,据此计算.
解答 解:(1)由图象得出反应A+B→C即反应物总能量大于生成物总能量,则该反应为放热反应,所以△H<0,反应A+B→X即反应物总能量小于生成物总能量,则该反应为吸热反应,所以△H1>0,X→C即反应物总能量大于生成物总能量,则该反应为放热反应,所以△H2<0;顾答案为:<;>;<;
(2)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),即断裂1molN-N键、4molN-H键和1molO=O键共吸收2752kJ-534kJ=2218kJ,设断裂1molN-H键所需的能量为xkJ,则有154+4x+500=2218,解得x=391,
故答案为:391kJ.
点评 本题考查学生根据反应物和生成物的能量大小判断吸放热以及化学键的断裂和生成与反应的吸放热之间的关系,题目难度不大.

练习册系列答案
相关题目
9.由CuO、Fe2O3组成的混合物中,两种化合物的物质的量之和是0.2 mol,放入500mL 1.0mol•L-1的盐酸溶液中,混合物恰好完全溶解.则混合物中CuO的物质的量为( )
| A. | 0.05mol | B. | 0.125mol | C. | 0.175mol | D. | 0.025mol |
16.下列解释事实的反应方程式正确的是( )
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓硫酸处理少量氨气:H2SO4+2NH3═(NH4)2SO4 |
8.在容积不变的密闭容器中加入1mol N2和3mol H2反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,下列结论正确的是( )
| A. | 该反应达到平衡时,放出的热量等于92.4kJ | |
| B. | 达到平衡后向容器中通入1mol氦气,容器内压强增大,平衡向右移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:



