题目内容
6.在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4•FeSO4•6H20],该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇.(1)配制FeSO4溶液时需要加入少量稀硫酸的目的是抑制FeSO4的水解.判断FeSO4溶液是否变质的方法是取适量FeSO4溶液于试管中,向溶液中加入KSCN溶液,若溶液变红,则说明FeSO4溶液变质,无现象则不变质.
(2)实验室通常向FeSO4溶液中加入饱和(NH4)2SO4溶液,然后经过“一系列操作”后得到硫酸亚铁铵晶体,其中“一系列操作”依次为蒸发浓缩、冷却结晶过滤、洗涤、干燥.
(3)为了洗涤硫酸亚铁铵晶体的粗产品,下列方法中最合适的是d(填字母).
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用Na2SO4溶液洗 d.用无水乙醇洗.
分析 (1)根据二价铁易发生水解反应分析;FeSO4溶液变质后生成Fe3+;
(2)步骤3是由溶液中获得晶体,是抑制亚铁离子的水解下的蒸发与结晶过程;
(3)依据该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇分析,洗涤不能溶解产品,不能引入新的杂质.
解答 解:(1)由于FeSO4易发生水解,故加入稀硫酸来抑制其水解;FeSO4溶液变质后生成Fe3+,故取适量FeSO4溶液于试管中,向溶液中加入KSCN溶液,若溶液变红,则说明FeSO4溶液变质,故答案为:抑制FeSO4的水解;取适量FeSO4溶液于试管中,向溶液中加入KSCN溶液,若溶液变红,则说明FeSO4溶液变质,无现象则不变质;
(2)步骤3是由溶液中获得晶体,亚铁离子在加热过程中会发生水解,应在抑制亚铁离子的水解情况下,蒸发浓缩、冷却结晶、过滤、洗涤等.
故答案为:蒸发浓缩、冷却结晶;
(3)因为硫酸亚铁铵易溶于水,不溶于乙醇,应该用乙醇洗涤,减少硫酸亚铁铵的溶解,同时利用乙醇和水互溶,从而达到洗涤的要求,故选d.故答案为:d.
点评 本题考查溶液的加热、过滤、固体溶解、蒸发(防水解)、结晶等一系列实验基本操作、离子检验等,难度不大,是对所学知识的综合运用,注意基础知识的掌握.

练习册系列答案
相关题目
17.以下化合物中,既含有离子键,又含有极性键的是( )
| A. | NaOH | B. | Na2O2 | C. | MgCl2 | D. | H2O2 |
5.某学习研究小根据金属锌、铝、铁分别与稀盐酸反应的相对速率,探究金属锌、铝、铁的金属活动性和反应速率测定.
【实验设计】为了达到实验目的,必须控制实验条件.你认为控制的实验条件是(可填满也可不填满)
(1)反应体系的温度(相同);(2)盐酸的浓度(相同);(3)取用盐酸的体积(相同);(4)金属的(比)表面积(或金属粉末的粗细程度)(相同).
【实验探究】该学习研究小组在上述实验条件相同的情况下,进行三组实验:各量取50mL稀盐酸于小烧杯中,分别同时加入足量的三种表面无氧化膜的金属片,用pH计测定溶液的pH并将信息传输到电脑,电脑动态地绘制出溶液中c(H+)随时间t的变化曲线(反应过程中溶液的体积没有变化).图1是反应到t1s时电脑记录的曲线:
【交流与表达】根据上述c(H+)随时间t的变化曲线回答下列问题: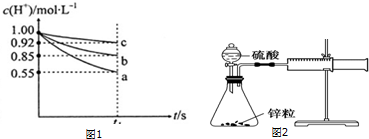
(1)表示金属活动性最弱的金属与H+反应的变化曲线是c(填“a”、“b”或“c”编号).
(2)在同一时间内,表示不同反应的反应速率可以有:同温同压下放出氢气的体积V(H2);溶液中H+浓度的减少△c(H+);固体减少的量△m或△n.在0一t1s之间,设A1和Zn分别与盐酸反应的速率为v(Al)和v(Zn):
Ⅰ.若以溶液中c(H+)减少来表示不同反应的速率,即v(Al):v(Zn)═3:1;
Ⅱ.若以固体质量的减轻来表示不同反应的速率,即v(Al):v(Zn)═54:65;
Ⅲ.若以固体物质的量减少来表示不同反应的速率,即v(Al):v(Zn)═2:1.
IV.可以利用图2所示的装置测定不同浓度的硫酸与锌的反应速率,请回答下列问题:
按照上述装置图安装3套相同的装置,并检验装置气密性良好,将注射器的活栓推至“0”刻度处;然后在三个锥形瓶中分别放入相同形状的锌粒2g,并分别通过分液漏斗在锥形瓶中加入1mol•L-1、2mol•L-1和4mol•L-1的稀硫酸40mL.请补全下表空白:
请选择一组合适的数据填写在第②组实验中的a、b处B.
A.12和0.83B.6和1.67C.1和10D.6和3.67.
【实验设计】为了达到实验目的,必须控制实验条件.你认为控制的实验条件是(可填满也可不填满)
(1)反应体系的温度(相同);(2)盐酸的浓度(相同);(3)取用盐酸的体积(相同);(4)金属的(比)表面积(或金属粉末的粗细程度)(相同).
【实验探究】该学习研究小组在上述实验条件相同的情况下,进行三组实验:各量取50mL稀盐酸于小烧杯中,分别同时加入足量的三种表面无氧化膜的金属片,用pH计测定溶液的pH并将信息传输到电脑,电脑动态地绘制出溶液中c(H+)随时间t的变化曲线(反应过程中溶液的体积没有变化).图1是反应到t1s时电脑记录的曲线:
【交流与表达】根据上述c(H+)随时间t的变化曲线回答下列问题:

(1)表示金属活动性最弱的金属与H+反应的变化曲线是c(填“a”、“b”或“c”编号).
(2)在同一时间内,表示不同反应的反应速率可以有:同温同压下放出氢气的体积V(H2);溶液中H+浓度的减少△c(H+);固体减少的量△m或△n.在0一t1s之间,设A1和Zn分别与盐酸反应的速率为v(Al)和v(Zn):
Ⅰ.若以溶液中c(H+)减少来表示不同反应的速率,即v(Al):v(Zn)═3:1;
Ⅱ.若以固体质量的减轻来表示不同反应的速率,即v(Al):v(Zn)═54:65;
Ⅲ.若以固体物质的量减少来表示不同反应的速率,即v(Al):v(Zn)═2:1.
IV.可以利用图2所示的装置测定不同浓度的硫酸与锌的反应速率,请回答下列问题:
按照上述装置图安装3套相同的装置,并检验装置气密性良好,将注射器的活栓推至“0”刻度处;然后在三个锥形瓶中分别放入相同形状的锌粒2g,并分别通过分液漏斗在锥形瓶中加入1mol•L-1、2mol•L-1和4mol•L-1的稀硫酸40mL.请补全下表空白:
| 序号 | 加入的稀硫酸浓度 | 反应时间/min | 收集的气体/mL | 反应速率mL•min-1 |
| ① | 1mol•L-1 | 11 | 10 | |
| ② | 2mol•L-1 | a | 10 | b |
| ③ | 4mol•L-1 | 10 | 5.0 |
A.12和0.83B.6和1.67C.1和10D.6和3.67.
9.如图1为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
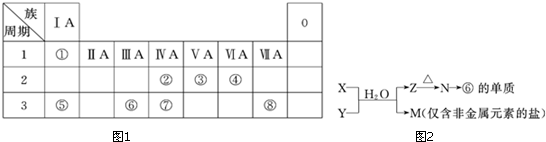
(1)地壳中含量居于第二位的元素在周期表中的位置是第三周期第ⅣA族.
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:同主族自上而下电子层增大,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式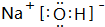 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)c.
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生图2反应:
X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-),
M中阳离子的鉴定方法取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.

(1)地壳中含量居于第二位的元素在周期表中的位置是第三周期第ⅣA族.
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:同主族自上而下电子层增大,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
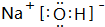 .
.(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)c.
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH═Na2SO3+2H2O |
X溶液与Y溶液反应的离子方程式Al3++3NH3+3H2O═Al(OH)3↓+3NH4+,
N→⑥的单质的化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-),
M中阳离子的鉴定方法取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子.
 燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.
燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.
 回答下列问题:
回答下列问题: