题目内容
下列物质中,能够导电的电解质是( )
| A、稀硫酸溶液 | B、蔗糖 |
| C、铜导线 | D、熔融的NaCl |
考点:电解质与非电解质
专题:
分析:在水溶液里或熔融状态下能导电的化合物是电解质,能导电的物质中含有自由电子或离子,据此分析解答.
解答:
解:A、稀硫酸溶液中含有自由移动的阴阳离子所以能导电,但溶液是混合物,所以不是电解质,故A错误;
B、蔗糖溶液中没有自由移动的钠离子和氯离子,不能导电,不是电解质,故B错误;
C、铜丝能导电,但铜丝是单质不是化合物,所以铜丝不是电解质也不是非电解质,故C错误.
D、熔融的NaCl中含有自由移动的离子,所以能导电,熔融的NaCl是能导电的电解质,故D正确.
故选D.
B、蔗糖溶液中没有自由移动的钠离子和氯离子,不能导电,不是电解质,故B错误;
C、铜丝能导电,但铜丝是单质不是化合物,所以铜丝不是电解质也不是非电解质,故C错误.
D、熔融的NaCl中含有自由移动的离子,所以能导电,熔融的NaCl是能导电的电解质,故D正确.
故选D.
点评:本题考查了电解质和非电解质的判断,难度不大,一定要注意无论电解质还是非电解质都首先必须是化合物(也是纯净物).

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
已知下列热化学方程式,且b>a.Hg(l)+
O2(g)=HgO(s)△H=-a kJ?mol-1Zn(s)+
O2(g)=ZnO(s)△H=-b kJ?mol-1由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、-(b-a) kJ?mol-1 |
| B、+(b-a) kJ?mol-1 |
| C、(b-a) kJ?mol-1 |
| D、(b+a) kJ?mol-1 |
下列物质与硝酸银溶液相遇能产生白色沉淀的是( )
| A、Cl2 |
| B、CCl4 |
| C、KClO3 |
| D、AlCl3 |
含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A、2.0mol/L |
| B、1.5 mol/L |
| C、0.18 mol/L |
| D、0.24mol/L |
下列状态的物质,既能导电又属于电解质的是( )
| A、MgCl2晶体 |
| B、NaCl溶液 |
| C、液态酒精 |
| D、熔融的KOH |
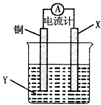 根据反应为 2Cu+O2+CO2+H2O=Cu2(OH)2CO3,设计如图所示原电池,下列说法错误的是( )
根据反应为 2Cu+O2+CO2+H2O=Cu2(OH)2CO3,设计如图所示原电池,下列说法错误的是( )| A、X可以是银或石墨 |
| B、电子从铜电极经外电路流向X电极 |
| C、Y是硫酸铜溶液 |
| D、X极上的电极反应式为 O2+2H2O+4e-=4OH- |