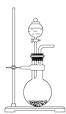
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩA «”…ΒΦ»»≤ΡΝœ÷Τ≥…ΒΡΟή±’»ίΤςΘ§B «“ΜΡΆΜ·―ßΗ· ¥«““Ή”Ύ¥Ϊ»»ΒΡΤχ«ρΓΘΙΊ±’K2Θ§ΫΪΒ»ΝΩ«“…ΌΝΩΒΡNO2Ά®ΙΐK1ΓΔK3Ζ÷±π≥δ»ΥAΓΔB÷–Θ§Ζ¥”ΠΤπ Φ ±Θ§AΓΔBΒΡΧεΜΐœύΆ§ΓΘ(“―÷ΣΘΚ2NO2 ![]() N2O4ΘΜΓςH<0)
N2O4ΘΜΓςH<0)

Θ®1Θ©“ΜΕΈ ±ΦδΚσΘ§Ζ¥”Π¥οΒΫΤΫΚβΘ§¥Υ ±AΓΔB÷–…ζ≥…ΒΡN2O4ΒΡΥΌ¬ «VA_______VBΓΘ(ΧνΓΑ>Γ±ΓΔΓΑ<Γ±ΓΔΓΑ=Γ±)ΘΜ»τ¥ρΩΣΜν»ϊK2Θ§Τχ«ρBΫΪ___________(ΧνΘΚ±δ¥σΓΔ±δ–ΓΓΔ≤Μ±δ)ΓΘ
Θ®2Θ©»τ‘ΎAΓΔB÷–‘Ό≥δ»κ”κ≥θ ΦΝΩœύΒ»ΒΡNO2Θ§‘ρ¥οΒΫΤΫΚβ ±Θ§NO2ΒΡΉΣΜ·¬ ΠΝAΫΪ______(Χν‘ω¥σΜρΦθ–ΓΓΔ≤Μ±δ)ΘΜ»τΆ®»κΒ»ΝΩΒΡNeΤχΘ§‘ρ¥οΒΫΤΫΚβ ±Θ§A÷–NO2ΒΡΉΣΜ·¬ ΫΪ_____Θ§B÷–NO2ΒΡΉΣΜ·¬ ΫΪ_______(ΧνΘΚ ±δ¥σΓΔ±δ–ΓΓΔ≤Μ±δ)ΓΘ
Θ®3Θ© “Έ¬œ¬Θ§»τAΓΔBΕΦ±Θ≥÷ΧεΜΐ≤Μ±δΘ§ΫΪAΧΉ…œ“ΜΗωΨχ»»≤ψΘ§B”κΆβΫγΩ…“‘Ϋχ––»»¥ΪΒίΘ§‘ρ¥οΒΫΤΫΚβ ±Θ§___________÷–ΒΡ―’…ΪΫœ…νΓΘ
ΓΨ¥πΑΗΓΩ< ±δ–Γ ‘ω¥σ ≤Μ±δ ±δ–Γ A
ΓΨΫβΈωΓΩ
Θ®1Θ©”…Χβ“βΩ…÷ΣΘ§A «ΚψΈ¬Κψ»ίΒΡΉΑ÷ΟΘ§B «ΚψΈ¬Κψ―ΙΒΡΉΑ÷ΟΓΘΗΟΖ¥”Π «ΧεΜΐΦθ–ΓΒΡΖ≈»»Ζ¥”ΠΘ§Υυ“‘ΥφΉ≈Ζ¥”ΠΒΡΫχ––Θ§A÷–ΒΡ―Ι«ΩΦθ–ΓΘ§Ι VA<VBΘΜ»τ¥ρΩΣΜν»ϊK2Θ§œύΒ±”Ύ’ϊΧΉΉΑ÷Ο±δΈΣΚψΈ¬Κψ―ΙΘ§Υυ“‘Τχ«ρBΫΪ±δ–ΓΘΜ
Θ®2Θ©‘Ό≥δ»κ”κ≥θ ΦΝΩœύΒ»ΒΡNO2Θ§A «Κψ»ίΉΑ÷ΟΘ§œύΒ±”Ύ‘ω¥σ―Ι«ΩΘ§ΤΫΚβ’ΐœρ“ΤΕ·Θ§NO2ΒΡΉΣΜ·¬ ΠΝAΫΪ‘ω¥σΓΘ»τΆ®»κΒ»ΝΩΒΡNeΤχΘ§A÷–Έο÷ ΒΡ≈®Ε»≤Μ±δΘ§ΤΫΚβ≤Μ“ΤΕ·Θ§NO2ΒΡΉΣΜ·¬ ≤Μ±δΘΜΕχB «Κψ―ΙΉΑ÷ΟΘ§Υυ“‘»ίΤςΧεΜΐ‘ω¥σΘ§ΤΫΚβΡφœρ“ΤΕ·Θ§NO2ΒΡΉΣΜ·¬ ±δ–ΓΘΜ
Θ®3Θ©ΗΟΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§»τΫΪAΧΉ…œΓΣΗωΨχ»»≤ψΘ§ΥφΉ≈Ζ¥”ΠΒΡΫχ––Θ§A÷–Έ¬Ε»…ΐΗΏΘ§ΤΫΚβΡφœρ“ΤΕ·Θ§NO2ΒΡ≈®Ε»‘ω¥σΘ§Υυ“‘A÷–ΒΡ―’…ΪΫœ…νΓΘ

 Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗ
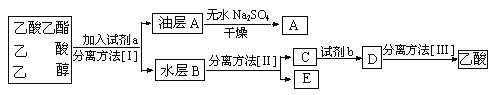
Οϊ–ΘΩΈΧΟœΒΝ–¥πΑΗΓΨΧβΡΩΓΩœ¬Ν– Β―ι≤ΌΉςΦΑœ÷œσΡήΒΟ≥ωœύ”ΠΫα¬έΒΡ «![]()
―Γœν | ≤ΌΉς | œ÷œσ | Ϋα¬έ |
A | ΫΪKIΚΆ | œ¬≤ψ»ή“Κœ‘ΉœΚλ…Ϊ | ―θΜ·–‘ΘΚ
|
B | œρ Δ”– | 2minΚσΘ§ ‘Ιήάο≥ωœ÷ΡΐΫΚ | Ζ«Ϋπ τ–‘ΘΚ
|
C |
| œ»≥ωœ÷ΑΉ…Ϊ≥ΝΒμΚσ”÷”–ΚλΚ÷…Ϊ≥ΝΒμ≤ζ…ζ | »ήΫβΕ»ΘΚ
|
D | œρ | ”–ΚΎ…Ϊ≥ΝΒμ | Υα–‘ΘΚ
|
A.AB.BC.CD.D
ΓΨΧβΡΩΓΩΨγΕΨΈο«ηΜ·ΡΤ(NaCN)ΙΧΧε”ωΥ°ΜρΥα…ζ≥…ΨγΕΨ“Ή»ΦΒΡ HCN ΤχΧεΘ§Ά§ ± HCN ”÷Ρή”κΥ°ΜΞ»ήΘ§‘λ≥…Υ°Έέ»ΨΓΘ“―÷Σ≤ΩΖ÷»θΥαΒΡΒγάκΤΫΚβ≥Θ ΐ»γœ¬±μΘΚ
»θΥα | HCOOH | HCN | H2CO3 |
ΒγάκΤΫΚβ≥Θ ΐ(25Γφ) | KaΘΫ1.77ΓΝ10-4 | KaΘΫ5.0ΓΝ10-10 | Ka1ΘΫ4.3ΓΝ10Θ≠7 |
Ka2ΘΫ5.6ΓΝ10-11 |
œ¬Ν–―Γœν¥μΈσΒΡ «( )
A.œρNaCN»ή“Κ÷–Ά®»κ…ΌΝΩCO2ΖΔ…ζΒΡάκΉ”Ζ¥”ΠΈΣ2CNΘ≠ΘΪH2OΘΪCO2=2HCNΘΪ![]()
B.œύΆ§≈®Ε»ΒΡ HCOOHΚΆNaCN ΒΡ»ή“Κ÷–Θ§Υ°ΒΡΒγάκ≥ΧΕ»«Α’Ώ–Γ
C.÷–ΚΆΒ»ΧεΜΐΓΔΒ»pH ΒΡ HCOOH »ή“ΚΚΆ HCN »ή“ΚœϊΚΡ NaOH ΒΡΈο÷ ΒΡΝΩ«Α’Ώ–Γ”ΎΚσ’Ώ
D.Β»ΧεΜΐΓΔΒ»Έο÷ ΒΡΝΩ≈®Ε»ΒΡ HCOONa ΚΆ NaCN »ή“Κ÷–ΥυΚ§άκΉ”Ήή ΐ«Α’Ώ¥σ”ΎΚσ’Ώ