题目内容
把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g·℃)],轻轻搅动.已知弱酸或弱碱在电离时需要吸收热量.实验中测得酸碱混合液的温度变化数据如下:

(1)中和热是指酸与碱反应生成1mol 时所放出的热量,试计算上述两组实验测出的中和热:
时所放出的热量,试计算上述两组实验测出的中和热: _________;
_________; _________.
_________.
(2)实验中碱液过量的目的是______________________________.
(3)两组实验结果差异的原因是______________________________.
答案:略
解析:
解析:
|
(1) 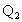 =52.7kJ/mol. =52.7kJ/mol.
(2) 碱液过量是为了提高实验准确度.(3)NaOH 是强碱,在水溶液中完全电离,跟HCl中和时放热较多, 是弱碱,只是少部分电离,发生电离时要吸热,中和时放热较少. 是弱碱,只是少部分电离,发生电离时要吸热,中和时放热较少.
(1)根据给出的酸和碱的物质的量,酸为0.050mol,碱为0.055mol,碱是过量的,应以酸计算,算出生成0.050mol水放出的热量,进而算出生成1mol水放出的热量,即可得出两组实验测出的中和热数值.
(2)碱液过量是为了提高实验准确度,因NaOH溶液易吸收  而使NaOH浓度下降, 而使NaOH浓度下降, 易挥发也使 易挥发也使 浓度下降. 浓度下降.
(3)NaOH是强碱,在水溶液中完全电解,跟HCl中和时放热较多,  是弱碱,只是少部分电离,发生电离时要吸热,中和时放热较少. 是弱碱,只是少部分电离,发生电离时要吸热,中和时放热较少. |

练习册系列答案
相关题目
把温度为13 ℃、浓度为1.0 mol·L-1的酸溶液和1.1 mol·L-1的碱溶液各50 mL混合,轻轻搅动。测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1℃ | 终了温度 |
HCl+NaOH HCl+NH3·H2O | 13 13 | 19.8 19.3 |
试计算上述两组实验测出的中和热数值,并回答为什么碱液过量,两组实验结果误差的原因。
把温度为13℃、浓度为0.5 mol/L的酸溶液和0.55 mol/L的碱溶液各50 mL混合[溶液密度均为1 g/mL,所生成溶液的比热容c=4.2 J/(g·℃)],轻轻搅动。测得酸碱混合液的温度变化数据如下:
| 反应物 | 起始温度t1(℃) | 末温度t2(℃) | 中和热(kJ·mol-1) |
| HCl+NaOH | 13.0 | 16.4 | ΔH1 |
| HCl+NH3·H2O | 13.0 | 16.0 | ΔH2 |
(1)试计算上述两组实验测出的中和热:ΔH1=_________;ΔH2=_________。
(2)实验中碱液过量的目的是______________ __。
(3)两组实验结果有较大差异的主要原因是________ __。
 =56.9kJ/mol
=56.9kJ/mol

