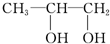
题目内容
1.下列实验方案不可行的是( )| A. | 用碱石灰干燥氨气 | |
| B. | 用紫色石蕊试液检验酸性溶液 | |
| C. | 通入Cl2除去FeCl3溶液中的FeCl2 | |
| D. | 加入Fe粉除去Al3+溶液中的杂质Cu2+ |
分析 A.氨气与碱石灰不反应;
B.酸遇石蕊变红;
C.氯气与氯化亚铁反应生成氯化铁;
D.Fe与Cu2+反应生成Cu和Fe2+.
解答 解:A.氨气与碱石灰不反应,可碱石灰干燥氨气,故A正确;
B.酸遇石蕊变红,则用紫色石蕊试液检验酸性溶液,故B正确;
C.氯气与氯化亚铁反应生成氯化铁,则通入Cl2除去FeCl3溶液中的FeCl2,故C正确;
D.Fe与Cu2+反应生成Cu和Fe2+,引入新杂质Fe2+,不符合除杂的原则,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的干燥、物质的检验及混合物分离提纯等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
11. 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:
请回答下列问题.
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:甲醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:C2A4分子中C原子轨道的杂化类型是sp3.
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
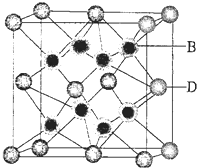
(5)B与D可形成离子化合物.其晶胞结构如图所示.其中D离子的配位数为8.若该晶体的密度为a g•cm-3,则该晶胞中距离最近的B和D之间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{ρ{N}_{A}}}$cm(写出表达式即可,NA代表阿伏加得罗常数)
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A元素的一种原子没有中子,只有一个质子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:甲醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:C2A4分子中C原子轨道的杂化类型是sp3.
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物.其晶胞结构如图所示.其中D离子的配位数为8.若该晶体的密度为a g•cm-3,则该晶胞中距离最近的B和D之间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{ρ{N}_{A}}}$cm(写出表达式即可,NA代表阿伏加得罗常数)
12.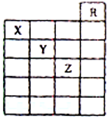 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②X、Y的气态氢化物的水溶液的酸性X<Y
③Z的单质常温下的是液体,可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐
②X、Y的气态氢化物的水溶液的酸性X<Y
③Z的单质常温下的是液体,可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A. | 只有①③ | B. | 只有①④ | C. | 只有①②③④ | D. | 全部都是 |
9.把质量为mg的铜丝灼烧变黑后,立即放入下列物质中,铜丝变红且质量不变的是( )
| A. | CH3COOH | B. | NaOH溶液 | C. | CH3CH2OH | D. | 稀HNO3 |
16.下列各组物质中,硫元素的化合价均为+4的是( )
| A. | Na2SO3 | B. | H2S2O7 | C. | Na2SO4 | D. | Na2S2O3 |
6.下列说法不正确的是( )
| A. | 油脂能发生皂化反应 | B. | 蛋白质水解的最终产物是氨基酸 | ||
| C. | 纤维素不能发生水解反应 | D. | 淀粉完全水解的产物是葡萄糖 |
13.将Cl2通入自来水中杀菌消毒,主要是利用了Cl2和H2O生成的HClO的( )
| A. | 强氧化性 | B. | 酸性 | C. | 还原性 | D. | 稳定性 |
12.下列说法正确的是( )
| A. | 化合物 按系统命名法的名称为2,3一二甲基丁烷 按系统命名法的名称为2,3一二甲基丁烷 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 等质量的聚乙烯、甲烷、乙烯分别充分燃烧,所耗氧气的量依次减少 | |
| D. | 通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 |
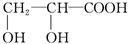 乙:
乙: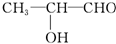
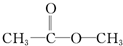 丁:
丁: