题目内容
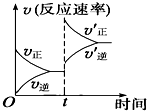 制取水煤气的反应为C(s)+H2O(g)?CO(g)+H2(g)△H>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
制取水煤气的反应为C(s)+H2O(g)?CO(g)+H2(g)△H>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )| A、加压 | B、升温 |
| C、增大水蒸气浓度 | D、增大碳的物质的量 |
考点:化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:温度和压强能引起正逆反应速率瞬间变化,升高温度,正逆反应速率加快,化学平衡向着吸热方向进行,增大压强,正逆反应速率加快,化学平衡向着气体体积减小的方向进行,改变反应物的浓度只能引起某个方向的速率瞬间变化,据此回答判断.
解答:
解:从图中看出,t时刻,正逆反应速率迅速增大,所以是加压或是升温,但是正反应速率快于逆反应速率,所以平衡正向进行,所以改变的条件是升高温度.
故选B.
故选B.
点评:本题以图象题为载体,考查学生影响化学反应速率的因素和平衡移动的因素,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
 在10~18号元素中,能用如图表示的微粒有几种( )
在10~18号元素中,能用如图表示的微粒有几种( )| A、1 | B、2 | C、3 | D、4 |
苯酚和苯甲醇共同具有的化学性质是( )
| A、一定条件下能与Na反应放出H2 |
| B、与NaOH溶液加热能发生反应 |
| C、能与FeCl3溶液反应 |
| D、加入浓溴水能生成白色沉淀 |
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )| A、遇FeCl3溶液发生显色反应 |
| B、易发生氧化反应和取代反应,较难发生加成反应 |
| C、可与碳酸氢钠溶液反应放出CO2气体 |
| D、1mol EGC与4mol NaOH恰好完全反应 |
下列离子方程式中正确的是( )
| A、向硫酸铜蓝色溶液中加入BaCl2溶液:Ba2++SO42-═BaSO4↓ | ||||
| B、碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ | ||||
| C、锌与盐酸的反应:Zn+2H++2Cl-═Zn2++2Cl-+H2↑ | ||||
D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
|
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际上乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-═X+2H+.下列说法中正确的是( )
| A、电池内部H+由正极向负极移动 |
| B、X为CH3CHO |
| C、乙醇在正极发生反应,电子经过外电路流向负极 |
| D、另一极的电极反应式为O2+4e-+2H2O═4OH- |
下列实验操作不正确的是( )
| A、蒸发结晶时,应将蒸发皿中的NaCl溶液全部蒸干才停止加热 |
| B、蒸馏实验中,要在烧瓶中加入沸石或碎瓷片,以防止液体暴沸 |
| C、用托盘天平称量药品时,将砝码置于天平右盘 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,应冷却至室温再转移到容量瓶中 |



