题目内容
1.8g CH4含有N个分子,则18g H2O中含有的分子数为2N,含有的原子数为6N,含有的氧原子数为2N.分析 根据n=$\frac{m}{M}$计算甲烷、水的物质的量,分子数目之比等于物质的量之比,水分子含有原子数目为水分子的3倍,含有氧原子数目等于水分子数目.
解答 解:8gCH4含有N个分子,甲烷物质的量为$\frac{8g}{16g/mol}$=0.5mol,18g H2O的物质的量为$\frac{18g}{18g/mol}$=1mol,分子数目之比等于物质的量之比,故水分子数目为N×$\frac{1mol}{0.5mol}$=2N,含有原子数目为2N×3=6N,含有氧原子数目等于水分子数目,即含有氧原子数目为2N,
故答案为:2N;6N;2N.
点评 本题考查物质的量有关计算,比较基础,注意对化学式的理解,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列官能团不只属于一类有机物的是( )
| A. | Cl | B. | CHO | C. | OH | D. | COOH |
12.下列有机物在水中的溶解度,排序正确的是( )
a.HOCH2CH2CH2OH b.CH3CH2CH2OH
c.CH3CH2COOCH3 d.
a.HOCH2CH2CH2OH b.CH3CH2CH2OH
c.CH3CH2COOCH3 d.

| A. | d>b>c>a | B. | c>d>a>b | C. | d>a>b>c | D. | c>d>b>a |
10.下列同分异构体数目最少的是( )
| A. | 戊烷 | B. | 丁醇 | C. | 丁烯 | D. | 乙酸乙酯 |
16. 2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )
 2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,该反应过程能量变化如图所示,下列叙述中正确的是( )| A. | 该反应的反应物总能量小于生成物总能量 | |
| B. | 该反应的逆反应为吸热反应 | |
| C. | 图中△H=-99kJ•mol-1, | |
| D. | 图中字母E所示能量值表示该反应的活化能 |
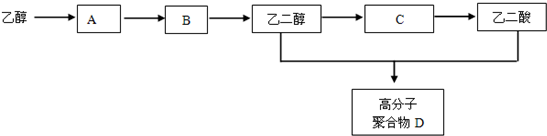

 +(2n-1)H2O 反应类型为聚合反应.
+(2n-1)H2O 反应类型为聚合反应.