题目内容
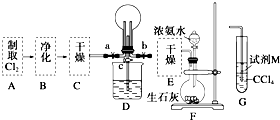 某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如图:
某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如图:①利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管).请写出A中发生反应的离子方程式
②已知3Cl2+2NH3═6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为
考点:氯气的实验室制法,氨的实验室制法
专题:
分析:①实验室用二氧化锰与浓盐酸在加热条件反应制备氯气;氯气有强氧化性,能氧化还原性的微粒,根据溶液中颜色的变化判断微粒氧化性的强弱;
②氯气和氨气发生氧化还原反应生成氯化氢和氮气,氯化氢和氨气相遇生成白色烟氯化铵;反应后烧杯内的气体压强变小.
②氯气和氨气发生氧化还原反应生成氯化氢和氮气,氯化氢和氨气相遇生成白色烟氯化铵;反应后烧杯内的气体压强变小.
解答:
解:I.①二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,离子方程式:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;氯气有氧化性,要检验微粒的氧化性,应该选择还原性的物质,所以M是FeI2;
氯气先和碘离子反应生成碘单质,四氯化碳能萃取碘,所以下层由无色变成紫红色,碘离子完全被氧化后,氯气再和亚铁离子反应生成铁离子,使上层溶液由亚铁离子颜色变成铁离子颜色,即由浅绿色变成黄色,由此证明氧化性Cl2>Fe3+>I2,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;FeI2;先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色;
②氯气和氨气发生氧化还原反应生成氯化氢和氮气,氯化氢和氨气相遇生成白色烟氯化铵,所以看到现象:
黄绿色气体消失,产生白烟;反应后烧杯内的气体压强变小,烧杯中的液体进入烧瓶中,形成喷泉;
故答案为:黄绿色气体消失,产生白烟;烧杯中的液体进入烧瓶中,形成喷泉.
| ||
氯气先和碘离子反应生成碘单质,四氯化碳能萃取碘,所以下层由无色变成紫红色,碘离子完全被氧化后,氯气再和亚铁离子反应生成铁离子,使上层溶液由亚铁离子颜色变成铁离子颜色,即由浅绿色变成黄色,由此证明氧化性Cl2>Fe3+>I2,
故答案为:MnO2+4H++2Cl-
| ||
②氯气和氨气发生氧化还原反应生成氯化氢和氮气,氯化氢和氨气相遇生成白色烟氯化铵,所以看到现象:
黄绿色气体消失,产生白烟;反应后烧杯内的气体压强变小,烧杯中的液体进入烧瓶中,形成喷泉;
故答案为:黄绿色气体消失,产生白烟;烧杯中的液体进入烧瓶中,形成喷泉.
点评:本题考查了氯气的制备和性质的验证,明确实验原理、氧化还原反应规律是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质中,既能与NaOH溶液反应,又能与盐酸反应,还能发生水解反应的是( )
①AlCl3 ②NaHSO4 ③(NH4)2CO3 ④CH3COONa ⑤NaHCO3.
①AlCl3 ②NaHSO4 ③(NH4)2CO3 ④CH3COONa ⑤NaHCO3.
| A、①④⑤ | B、③⑤ | C、④⑤ | D、全部 |
下列有关化学与生活、生产的叙述错误的是( )
| A、因为氮易液化,液氮在气化时会吸收大量的热量,所以液氮可作制冷剂 |
| B、盐卤点豆腐,明矾净水与胶体的性质有关 |
| C、H2O2、SO2、O3等都用于织物漂白,它们的漂白原理相同 |
| D、硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药 |
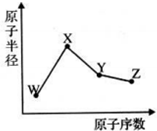 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强,下列说法正确的是( )| A、对应气态氢化物的稳定性Y>Z |
| B、化合物XZW既含离子键也含共价键 |
| C、对应简单离子半径W<X |
| D、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
质量百分比浓度分别为80%和20%的硫酸溶液等体积混合,混合溶液的质量百分比浓度为( )
| A、>50% | B、=50% |
| C、<50% | D、无法计算 |
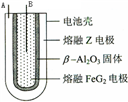 X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题: