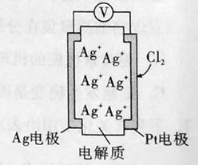
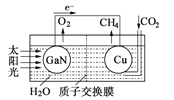
题目内容
【题目】配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因可能是 ( )
A. 容量瓶中原有少量蒸馏水
B. 称量药品时间过长
C. 定容时俯视液面
D. 洗涤烧杯和玻棒的溶液转入容量瓶中;
【答案】B
【解析】试题分析:容量瓶中原有少量蒸馏水无影响,故A错误;氢氧化钠吸水,称量药品时间过长,称得的氢氧化钠质量偏小,溶液浓度偏低,故B正确;定容时俯视液面,溶液体积偏小,浓度偏大,故C错误;洗涤烧杯和玻棒的溶液转入容量瓶中无影响,故D错误。

 优加精卷系列答案
优加精卷系列答案【题目】研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
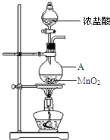
(1)仪器A的名称为_________;A中反应的离子方程式为______________________;
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | ____________________________ |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为______________________;
②不能证明产生的气体中含有HCl的实验是______________(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因______________;
(4)已知:2S2O32-+I2═S4O62-+2I-.丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2.取25.00mL溶液X,加入过量KI溶液,然后用0.04molL-1 Na2S2O3溶液滴定生成
的I2,达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10molL-1 AgNO3溶液滴定所得溶液中的Cl-.
①X中的HClO不会影响I的测定结果,原因是_________________________;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10molL-1 AgNO3溶液的体积应大于____________________mL(用含V的代数式表示)。