题目内容
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
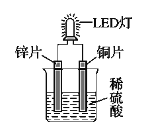
A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 铜片上的电极方程式为:2H+ + 2e- = H2↑
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
【答案】C
【解析】
根据原电池工作原理,分析解答有关问题。
A、该原电池中,锌比铜活泼,锌片为电池负极,铜为正极,铜不会失电子形成Cu2+,A项错误;
B、若将锌片换成铁片,铁仍比铜活泼,故电路中的电流方向不变,B项错误;
C、铜片为电池正极,电极反应为2H++2e-=H2↑,C项正确;
D、柠檬汁也是电解质溶液,若将稀硫酸换成柠檬汁,仍构成原电池,LED灯同样会发光,D项错误。
本题选C。

练习册系列答案
相关题目