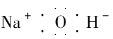题目内容
短周期非金属元素A、B、C的核电荷数依次增大,A原子的外围电子排布式为ns2np2,C是地壳中含量最多的元素。元素D、E都位于第四周期,其中E的核电荷数为29,D原子的核外未成对电子数在同周期中是最多的。请用对应的元素符号或化学式填空:
(1)元素A、B、C的第一电离能由小到大的顺序为________。
(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子数均满足8电子结构,则其结构式为________,1 mol该分子中含有的π键的数目为________。
(3)基态D原子的外围电子排布式为________。化合物DO2Cl2的熔点是-96.5 ℃,沸点是117 ℃,则固态DO2Cl2属于________晶体。

(4)已知元素E的氢化物的晶胞结构如上图所示,则其化学式为___________
(1)C<O<N (2)NCCN 4NA(或2.408×1024) (3)3d54s1 分子 (4)CuH
【解析】 由C是地壳中含量最多的元素知,C为O元素。又由A原子外围电子排布式ns2np2且核电荷数小于O元素知A为C元素,故B为N元素。由E的核电荷数为29,则E为Cu,D原子的核外未成对电子数在第四周期最多,则D为[Ar]3d54s1,故D为 Cr。(1)根据第二周期元素第一电离能递变规律和第ⅤA族电离能的特殊性知C、N、O元素的第一电离能由小到大为C<O<N。(2)由(CN)2的键角为180°,立体构型为直线形及对称性和8电子结构,得到(CN)2的结构式为NCCN,1 mol(CN)2中π键为4NA。(3)Cr的基态原子的外围电子排布式为3d54s1。由熔、沸点低知CrO2Cl2属于分子晶体。(4)由晶胞中Cu原子和H原子半径知原子半径大的为Cu,其数目为8×1/8+6×1/2=4,原子半径小的为H,其数目为4,故Cu的氢化物的化学式为CuH。

TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
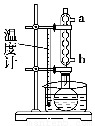
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:

有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l) H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2产率降低,原因是_________________________________________________
_______________________。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。