题目内容
6.下列与处理方法对应的反应方程式不正确的是( )| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O═2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3 (胶体)+3H+ |
分析 A.二氧化氮与水反应生成硝酸和NO气体;
B.一水合氨不能拆开,需要保留分子式;
C.氯气能够与氢氧化钙反应生成氯化钙、次氯酸钙和水;
D.铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有较大的表面积,能够净水.
解答 解:A.工业上用水吸收NO2生产硝酸,反应的化学方程式为3NO2+H2O=2HNO3+NO,故A正确;
B.用氨水除去工业原料氯化铵中的氯化铁杂质,反应生成氢氧化铁沉淀和氯化铵,正确的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故B错误;
C.用熟石灰处理泄漏的液氯,氢氧化钙与氯气反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,故C正确;
D.明矾除去水中的悬浮颗粒物,铝离子能够水解生成氢氧化铝胶体,反应的离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,故D正确;
故选B.
点评 本题考查了化学方程式、离子方程式的书写判断,题目难度中等,注意掌握离子方程式、化学方程式的书写原则,B为易错点,注意一水合氨为弱电解质,离子方程式中不能拆开.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
14.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是c、e(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol•L-1;该时间内反应速率v(CH3OH)=0.16mol/(L•min).
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是c、e(填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol•L-1;该时间内反应速率v(CH3OH)=0.16mol/(L•min).
1.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
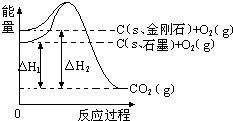

| A. | C(s、石墨)═C(s、金刚石)△H=+1.9kJ•mol-1 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 石墨的稳定性强于金刚石 | |
| D. | 1mol石墨的总键能比1mol金刚石的总键能小1.9kJ |
11.下列化合物中所有化学键都是共价键的是( )
| A. | Na2O2 | B. | NaOH | C. | BaCl2 | D. | H2SO4 |
15.下列叙述错误的是( )
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg12C含有约6.02×1023个碳原子 | |
| C. | 物质的量是国际单位制中七个基本物理量之一 | |
| D. | 在使用摩尔表示物质的量的单位时,应指明粒子的种类 |
16.下列关于乙烯的说法不正确的是( )
| A. | 无色气体,难溶于水 | B. | 含有碳碳双键 | ||
| C. | 可使溴水褪色 | D. | 燃烧时产生淡蓝色火焰 |

