题目内容
几种短周期元素的原子半径及主要化合价如下表,下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A、X、Y元素的金属性:X<Y |
| B、一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
| C、气态氢化物的稳定性:Z>W |
| D、一定条件下,Z单质与W的常见单质可直接生成ZW2 |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:W的化合价只有-2价,故W为氧元素;Z具有-3、+5价,原子半径大于氧元素且相差不大,故Z为氮元素;X只有+2价,Y只有+3价,X、Y原子半径相差不大,原子半径较氮元素、氧元素大很多,可知X、Y位于第三周期相邻主族,故X为镁元素,Y为铝元素.结合元素周期律与物质性质解答.
解答:
解:A、根据题给数据,X、Y的化合价不同,但原子半径相差较小,可知两者位于同一周期相邻主族,故金属性X>Y,故A错误;
B、一定条件下,氧气可以和氨气反应生成水和氮气,故B正确;
C、据此判断可知Z是N,W是O,非金属性越强对应氢化物的稳定性越强,气态氢化物的稳定性:Z<W,故C错误;
D、据此判断可知Z是N,W是O,两者的单质一定条件下直接生成NO,故D错误;
故选:B.
B、一定条件下,氧气可以和氨气反应生成水和氮气,故B正确;
C、据此判断可知Z是N,W是O,非金属性越强对应氢化物的稳定性越强,气态氢化物的稳定性:Z<W,故C错误;
D、据此判断可知Z是N,W是O,两者的单质一定条件下直接生成NO,故D错误;
故选:B.
点评:本题考查了物质结构与元素周期律知识.本题是一个好题,虽然对学生来说判断起来有点难度,但总起来还是可以明确找到答案,并准确作答.解答元素推断题的突破口可能是原子结构、元素在周期表中的位置、元素的性质等;在此题中解答时,关键是抓住元素性质和元素在周期表中的位置的关系,从原子半径的变化和元素的最高正价和最低负价入手寻求突破.

练习册系列答案
相关题目
下列有关试剂的保存方法错误的是( )
| A、少量的钠保存在煤油中 |
| B、新制的氯水保存在棕色试剂瓶中 |
| C、漂白粉要密闭保存 |
| D、浓盐酸保存在敞口试剂瓶中即可 |
下列化学用语表达不正确的是( )
A、次氯酸的电子式: | ||||
B、质子数为6、质量数为14的原子:
| ||||
| C、CS2的结构式:S-C-S | ||||
D、氯的原子结构示意图: |
已知强弱顺序:还原性I->Br->Fe2+>Cl-,氧化性Cl2>Fe3+>Br2>I2,下列反应的化学方程式或叙述不成立的是( )
| A、Br2+2HI═I2+2HBr |
| B、2FeCl2+Cl2═2FeCl3 |
| C、2FeCl2+2HCl+I2═2FeCl3+2HI |
| D、Cl2通入到NaBr和NaI的混合溶液中:I-先被氧化 |
下列表达式正确的是( )
A、O2-的结构示意图: | ||
B、碳原子的L层电子轨道表示式: | ||
| C、硫离子的核外电子排布式:1s22s22p63s23p4 | ||
D、碳-12原子:
|
下列各组物质分类正确的是( )
| 酸 | 碱 | 盐 | 氧化物 | |
| A | H2SO4 | Na2CO3 | NaCl | SiO2 |
| B | HBr | NaOH | Na2CO3 | CaO |
| C | CO2 | NH3?H2O | NaHCO3 | CuO |
| D | CH3COOH | KOH | KCl | HClO3 |
| A、A | B、B | C、C | D、D |
有关化学用语的表达正确的是( )
A、Na2O2电子式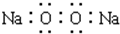 | ||
B、中子数为14的硅原子:
| ||
| C、二氧化硅的分子式SiO2 | ||
| D、乙烯的结构简式CH2CH2 |
下列关于物质的量、摩尔质量的叙述正确的是( )
| A、氢氧化钠的摩尔质量是40 g |
| B、1 mol H2O中含有2 mol氢和1 mol氧 |
| C、0.012 kg12C中含有约6.02×1023个碳原子 |
| D、2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
 工业上可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图如图所示,回答下列问题:
工业上可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图如图所示,回答下列问题: