题目内容
将200mL 0.5mol/L的NaOH溶液加水稀释到500mL,稀释后NaOH的物质的量浓度为( )
| A、0.3 mol/L |
| B、0.05mol/L |
| C、0.2 mol/L |
| D、0.04 mol/L |
考点:物质的量浓度的相关计算
专题:计算题
分析:根据稀释定律,稀释前后溶质NaOH的物质的量不变,据此计算稀释后NaOH溶液的物质的量浓度.
解答:
解:令稀释后NaOH溶液的物质的量浓度为c,根据稀释定律,稀释前后溶质NaOH的物质的量不变,则:
0.2L×0.5mol/L=0.5L×c
解得c=0.2mol/L
故选C.
0.2L×0.5mol/L=0.5L×c
解得c=0.2mol/L
故选C.
点评:本题考查物质的量浓度有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
 原子结构模型的演变图中,(1)为道尔顿实心球式原子模型、(2)为卢瑟福带核的原子模型、(3)为汤姆生葡萄干面包式原子模型、(4)为玻尔轨道式原子模型.其中符合历史演变顺序的一组排列是( )
原子结构模型的演变图中,(1)为道尔顿实心球式原子模型、(2)为卢瑟福带核的原子模型、(3)为汤姆生葡萄干面包式原子模型、(4)为玻尔轨道式原子模型.其中符合历史演变顺序的一组排列是( )| A、(1)(3)(2)(4) |
| B、(1)(2)(3)(4) |
| C、(1)(4)(3)(2) |
| D、(1)(3)(4)(2) |
下列说法正确的是( )
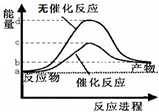

| A、根据如图知该反应有催化剂和无催化剂的活化能相差d-c,但其反应热均为a-b | ||
| B、若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5kJ/mol | ||
| C、需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | ||
| D、已知:Ⅰ:对于反应:3Si(s)+2N2(g)=Si3N4(s)△H=-a kJ/mol,Ⅱ:N≡N键能为bkJ?mol-1Si-Si键能为ckJ?mol-1 且a、b、c均大于零,则断开1 mol Si-N键所需的能量为
|
甲酸是一种一元有机酸,下列性质中可以证明它是弱电解质的是( )
| A、甲酸溶液的导电性比盐酸溶液的弱 |
| B、甲酸可以与碳酸钠溶液反应 |
| C、10mL 1mol?L-1的甲酸溶液恰好与10 mL 1mol?L-1 Na0H溶液完全反应 |
| D、0.1mol?L-1的甲酸溶液的pH约为3 |
下列关于化学键的叙述不正确的是( )
| A、离子化合物一定含有离子键 |
| B、共价键只存在于共价化合物中 |
| C、化学键的形成与成键原子结构有关,主要通过原子之间价电子的得失或共用来实现 |
| D、化学反应的本质是旧键断裂,新键形成 |
下列物质非电解质的是( )
| A、CO2 |
| B、AgCl |
| C、Cu |
| D、H2SO4 |
下列说法正确的是 ( )
| A、摩尔是国际单位制的七个基本物理量之一 |
| B、物质的量是表示数量的单位 |
| C、摩尔是物质的量的单位,符号为mol |
| D、1 mol任何物质都含有约6.02×1023个原子 |
下列有关金属腐蚀与防护的说法正确的是( )
| A、破损的镀锌铁在潮湿的空气中更易被腐蚀 |
| B、金属腐蚀就是金属原子失去电子被还原的过程 |
| C、当镀锡铁制品的镀层破损时,锡层仍能对铁制品起保护作用 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了电化学保护法 |