题目内容
【题目】图是以甲烷和O2构成的燃料电池电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是( )
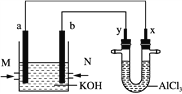
A. 原电池中电解质溶液的pH增大
B. 电解池中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. M处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO![]() +7H2O
+7H2O
D. 电解池中Cl-向x极移动
【答案】C
【解析】
原电池中,负极: CH4+10OH--8e-===CO![]() +7H2O,正极:2O2+4H2O+8e-=8OH-,总方程式:CH4+2O2+2OH-= CO
+7H2O,正极:2O2+4H2O+8e-=8OH-,总方程式:CH4+2O2+2OH-= CO![]() +3H2O ,溶液由碱变成盐溶液,所以溶液的PH值变小,故A错误.
+3H2O ,溶液由碱变成盐溶液,所以溶液的PH值变小,故A错误.
B、电解池中电池反应式为2AlCl3+2H2O![]() Cl2↑+H2↑+Al(OH)3故B错;C、. M处通入的气体为CH4,为甲烷在碱性介质中的燃料电池,且甲烷做负极,故电极反应式为CH4+10OH--8e-===CO
Cl2↑+H2↑+Al(OH)3故B错;C、. M处通入的气体为CH4,为甲烷在碱性介质中的燃料电池,且甲烷做负极,故电极反应式为CH4+10OH--8e-===CO![]() +7H2O,所以C正确;D、反应开始后观察到x电极附近出现白色沉淀,说明X电极上氢离子放电,X电极附近生成氢氧根离子,所以X电极是阴极,Y电极是阳极,则a负极,b是正极,电解池中,溶液中阳离子向阴极移动,阴离子向阳极移动,所以电解池中
+7H2O,所以C正确;D、反应开始后观察到x电极附近出现白色沉淀,说明X电极上氢离子放电,X电极附近生成氢氧根离子,所以X电极是阴极,Y电极是阳极,则a负极,b是正极,电解池中,溶液中阳离子向阴极移动,阴离子向阳极移动,所以电解池中![]() 向y极移动,故D错误. 所以C选项是正确的.
向y极移动,故D错误. 所以C选项是正确的.

【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
A.常温下0.1 mol·L-1 NaNO2溶液的pH>7
B.用一定浓度HNO2溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
D.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”),原因是___________________________。
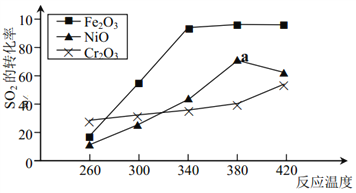
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
________(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是________。

(4)依据提供数据回答下列问题。
①求298K时,NaHSO3溶液中HSO3-水解平衡常数Kh =____;由此可判断HSO3-水解程度______电离程度(填“>”、“<”或“=”)。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
(5)298K时,向含有2mol Na2CO3的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。