题目内容
根据物质相似性、特殊性来学习元素性质是常见的学习方法.

(1)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性,请写出BeO与盐酸反应的离子方程式 ,Be(OH)2溶于NaOH溶液的化学方程式为:Be(OH)2+2NaOH═Na2BeO2+2H2O,往10.0mL1.00mol?L-1的Be(NO3)2溶液中逐滴加入等浓度的NaOH溶液,请在以下坐标图中画出沉淀量随NaOH溶液加人量的变化图:
(2)锗与硅元素相似,锗也是良好的半导体,以下是工业冶炼锗的简单流程图:
GeO2(粗)
GeCl4(粗)
GeCl4(纯)
GeCl2(纯)
Ge
①GeCl4的晶体类型为
②写出过程Ⅲ发生反应的化学方程式
③以下有关工业冶炼锗的说法正确的是
A.GeO2与SiO2性质相似,均易与盐酸反应
B.过程Ⅱ的蒸馏是利用GeCl4难溶于水的性质实现的
C.过程Ⅳ发生的反应中,GeO2作氧化剂
D.上述过程涉及的基本反应类型有复分解反应、置换反应
(3)某同学为了探究硫与浓硝酸的反应产物,将硫与浓硝酸混合,结果生成一种纯净无色气体A,A遇空气变红棕色,据此写出硫与浓硝酸反应的化学方程式 .

(1)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性,请写出BeO与盐酸反应的离子方程式
(2)锗与硅元素相似,锗也是良好的半导体,以下是工业冶炼锗的简单流程图:
GeO2(粗)
| 盐酸 |
| Ⅰ |
| 蒸馏 |
| Ⅱ |
| 水 |
| Ⅲ |
| Zn |
| Ⅳ |
①GeCl4的晶体类型为
②写出过程Ⅲ发生反应的化学方程式
③以下有关工业冶炼锗的说法正确的是
A.GeO2与SiO2性质相似,均易与盐酸反应
B.过程Ⅱ的蒸馏是利用GeCl4难溶于水的性质实现的
C.过程Ⅳ发生的反应中,GeO2作氧化剂
D.上述过程涉及的基本反应类型有复分解反应、置换反应
(3)某同学为了探究硫与浓硝酸的反应产物,将硫与浓硝酸混合,结果生成一种纯净无色气体A,A遇空气变红棕色,据此写出硫与浓硝酸反应的化学方程式
考点:碳族元素简介,元素周期律的作用
专题:
分析:(1)根据两性氧化物能与酸反应生成盐和水;根据Be(NO3)2溶液中逐滴加入等浓度的NaOH先后发生反应:Be(NO3)2+2NaOH=Be(OH)2↓+2NaNO3,Be(OH)2+2NaOH═Na2BeO2+2H2O,先产生沉淀,然后沉淀消失,两次消耗的氢氧化钠的物质的量都为0.02mol(即20mLNaOH溶液),产生的Be(OH)2沉淀为0.01mol;
(2)①根据GeCl4(粗)
GeCl4(纯)可知GeCl4的沸点较低;
②根据质量守恒书写方程式;
③A.GeO2与SiO2性质不相似,GeO2与盐酸反应,SiO2与盐酸不反应;
B.过程Ⅱ的蒸馏是利用GeCl4的沸点低来实现的;
C.过程Ⅳ发生的反应中,GeO2中Ge的化合价降低,作氧化剂;
D.过程Ⅰ、Ⅲ是复分解反应,过程Ⅳ是置换反应;
④将硫与浓硝酸混合,结果生成一种纯净无色气体A,A遇空气变红棕色,说明A为一氧化氮,由于浓硝酸的强氧化性,能将硫氧化成+6价的硫酸,然后根据质量守恒配平;
(2)①根据GeCl4(粗)
| 蒸馏 |
| Ⅱ |
②根据质量守恒书写方程式;
③A.GeO2与SiO2性质不相似,GeO2与盐酸反应,SiO2与盐酸不反应;
B.过程Ⅱ的蒸馏是利用GeCl4的沸点低来实现的;
C.过程Ⅳ发生的反应中,GeO2中Ge的化合价降低,作氧化剂;
D.过程Ⅰ、Ⅲ是复分解反应,过程Ⅳ是置换反应;
④将硫与浓硝酸混合,结果生成一种纯净无色气体A,A遇空气变红棕色,说明A为一氧化氮,由于浓硝酸的强氧化性,能将硫氧化成+6价的硫酸,然后根据质量守恒配平;
解答:
解:(1)BeO与盐酸反应的生成氯化铍和水,反应的离子方程式为:BeO+2H+=Be2++H2O;Be(NO3)2溶液中逐滴加入等浓度的NaOH先后发生反应:Be(NO3)2+2NaOH=Be(OH)2↓+2NaNO3,Be(OH)2+2NaOH═Na2BeO2+2H2O,先产生沉淀,然后沉淀消失,两次消耗的氢氧化钠的物质的量都为0.02mol(即20mLNaOH溶液),产生的Be(OH)2沉淀为0.01mol,沉淀量随NaOH溶液加人量的变化图为: ;
;
故答案为:BeO+2H+=Be2++H2O; ;
;
(2)①根据GeCl4(粗)
GeCl4(纯),可知GeCl4的沸点较低,则GeCl4为分子晶体;
故答案为:分子晶体;
②GeCl4与水反应生成GeO2和氯化氢,方程式为:GeCl4+2H2O=GeO2+4HCl;
故答案为:GeCl4+2H2O=GeO2+4HCl;
③③A.GeO2与SiO2性质不相似,GeO2与盐酸反应,SiO2与盐酸不反应,故A错误;
B.过程Ⅱ的蒸馏是利用GeCl4的沸点低来实现的,不是利用GeCl4难溶于水的性质实现的,故B错误;
C.过程Ⅳ发生的反应中,GeO2中Ge的化合价降低,作氧化剂,故C正确;
D.过程Ⅰ、Ⅲ是复分解反应,过程Ⅳ是置换反应,属于氧化还原反应,故D正确;
故选CD.
(3)将硫与浓硝酸混合,结果生成一种纯净无色气体A,A遇空气变红棕色,说明A为一氧化氮,由于浓硝酸的强氧化性,能将硫氧化成+6价的硫酸,化学方程式为:S+2HNO3=H2SO4+2NO↑;
故答案为:S+2HNO3=H2SO4+2NO↑;
 ;
;故答案为:BeO+2H+=Be2++H2O;
 ;
;(2)①根据GeCl4(粗)
| 蒸馏 |
| Ⅱ |
故答案为:分子晶体;
②GeCl4与水反应生成GeO2和氯化氢,方程式为:GeCl4+2H2O=GeO2+4HCl;
故答案为:GeCl4+2H2O=GeO2+4HCl;
③③A.GeO2与SiO2性质不相似,GeO2与盐酸反应,SiO2与盐酸不反应,故A错误;
B.过程Ⅱ的蒸馏是利用GeCl4的沸点低来实现的,不是利用GeCl4难溶于水的性质实现的,故B错误;
C.过程Ⅳ发生的反应中,GeO2中Ge的化合价降低,作氧化剂,故C正确;
D.过程Ⅰ、Ⅲ是复分解反应,过程Ⅳ是置换反应,属于氧化还原反应,故D正确;
故选CD.
(3)将硫与浓硝酸混合,结果生成一种纯净无色气体A,A遇空气变红棕色,说明A为一氧化氮,由于浓硝酸的强氧化性,能将硫氧化成+6价的硫酸,化学方程式为:S+2HNO3=H2SO4+2NO↑;
故答案为:S+2HNO3=H2SO4+2NO↑;
点评:本题主要考查了同主族元素性质的相似性和差异性,注意根据题意提取信息是解题的关键.

练习册系列答案
相关题目
下列物质属于电解质的是( )
| A、铜 | B、稀硫酸 |
| C、二氧化碳 | D、熔融氯化钠 |
如图X、Y、A、B、C均为短周期主族元素,下列说法不正确的是( )
| X | A | |
| Y | C | B |
| A、原子半径大小:Y>C>X>A |
| B、A、B的氢化物的稳定性:A>B |
| C、Y、C的最高价氧化物对应水化物的酸性:Y<C |
| D、B、C简单阴离子的还原性强弱为:B>C |

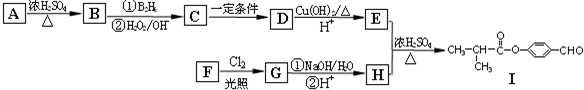
 R-CH2CH2OH;
R-CH2CH2OH;