��Ŀ����
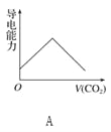
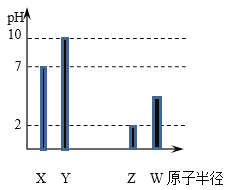
����Ŀ��ijǿ������ҺX�п��ܺ���Fe2����Fe3����Al3����Ba2����NH4+��CO32-��NO3-��SO42-��SiO32-�е������֣���ȡX��Һ��������ʵ�飬ʵ����̼�������ͼ��ʾ��ʵ���������һ������Ϊ����ɫ��
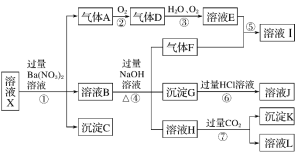
����������Ϣ���ش��������⣺
(1)��ǿ�������������ж�X��Һ�п϶������ڵ�������________
(2)��ҺX�й�����������ӵ��жϣ���ȷ����______(���ţ���ͬ)��
a��һ������ ��b��һ�������� ������c�����ܺ���
(3)������I�к��еĻ�ѧ��������____________
(4)ת���ߵ����ӷ���ʽΪ____________
(5)�Բ���ȷ���Ƿ���ڵ����ӣ�������ȡX��Һ������������Һ�е�һ�֣����������жϣ����Լ������________��
��NaOH��Һ����KSCN��Һ������ˮ��KSCN�Ļ����Һ����pH��ֽ����KMnO4��Һ
���𰸡�CO32-��SiO32- b ���ۼ������Ӽ� AlO2-��2H2O��CO2=HCO3-��Al(OH)3�� ��
��������
ǿ������Һ��һ��������CO32-��SiO32-������������ᱵ���ɳ�������ó���ΪBaSO4������˵��ԭ��Һ�к���SO42-���ӣ���Һ�д���SO42-����һ�������ں���������ӷ�Ӧ��Ba2+��C��BaSO4���������ᱵ��������A������A����������Ӧ��������D��D��H2O��O2���õ���ҺE�����ʵ���������һ������Ϊ����ɫ����ԭ��Һ�д���Fe2+������A��NO��DΪNO2��EΪ���������������������Ӿ���ǿ�����ԣ���������Һ��Fe2+��NO3-���ܹ��棬ԭ��Һ�в�����NO3-����ҺB�м����������������Һʱ����������F����ԭ��Һ�к���NH4+��F��NH3��NH3�����ᷴӦ��������泥�IΪ����泥�������ҺB�д���Fe3+�������G��Fe��OH��3����ҺH��ͨ�����������̼���ɳ���������ҺH�к���ƫ�������ԭ��Һ�д���Al3+������K��Al��OH��3����ҺL��NaHCO3������ҺX�п϶����е�������Al3+��SO42-��NH4+��Fe2+������ȷ���Ƿ���Fe3+��һ��������Ba2+��CO32-��SiO32-��NO3-��
��1��ǿ������Һ��һ���������CO32-��SiO32-���ʴ�Ϊ��CO32-��SiO32-��
��2���������ᱵ�������壬��ԭ��Һ�д���Fe2+��������������������Ӿ���ǿ�����ԣ���������Һ��Fe2+��NO3-���ܹ��棬ԭ��Һ�в�����NO3-����ѡb���ʴ�Ϊ��b��
��3��������IΪ����泥������Ϊ���ӻ�����������Ӽ����ۼ����ʴ�Ϊ�����ۼ������Ӽ���
��4��ת����Ϊƫ��������Һ�����������̼��Ӧ������������������̼�����ƣ���Ӧ�����ӷ���ʽΪAlO2-��2H2O��CO2=HCO3-��Al(OH)3�����ʴ�Ϊ��AlO2-��2H2O��CO2=HCO3-��Al(OH)3����
��5����Һ�в���ȷ���Ƿ���Fe3+����Ҫȷ��Fe3+���ڣ���õIJ��������ǣ�ȡԭ��Һ�������Թ��У����뼸��KSCN��Һ������Һ��Ϊ��ɫ����֤������Fe3+����֮���ޣ���ѡ�ڣ��ʴ�Ϊ���ڡ�

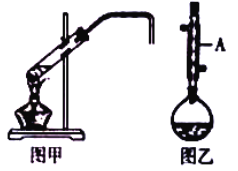
����Ŀ����ѧʵ��С������ʵ�����Ʊ������飨ͼ�ף���1���嶡�飨ͼ�ң����漰��ѧ��Ӧ���£�
NaBr+H2SO4�THBr+NaHSO4 ��
C2H5��OH+HBrC2H5��Br+H2O ��
CH3CH2CH2CH2��OH+HBrCH3CH2CH2CH2��Br+H2O ��
���ܴ��ڵĸ���Ӧ�У�����Ũ����Ĵ�������ˮ����ϩ���ѣ�Br����Ũ��������ΪBr2�ȡ��й������б����£�
�Ҵ� | ������ | ������ | 1���嶡�� | |
�ܶ�/gcm��3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
�е�/�� | 78.5 | 38.4 | 117.2 | 111.6 |
��ش��������⣺
��1��ͼ��������A������Ϊ_____��
��2���Ҵ��ķе����������ķе㣬��ԭ����_____��
��3����1���嶡��ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�������_____����ϲ㡱�����²㡱���ֲ㡱����
��4���Ʊ������У������Ũ����������ϡ�ͣ���Ŀ����_____��������ĸ��
A�����ٸ�����ϩ���ѵ�����
B������Br2������
C������HBr�Ļӷ�
D��ˮ�Ƿ�Ӧ�Ĵ���
��5������ȥ������е���������Br2���������������ʺϵ���_____��������ĸ��
A��NaIB��NaOHC��NaHSO3D��KCl
��6���Ʊ������飨ͼ�ף�ʱ�����ñ߷�Ӧ����������ķ�������������_____�����Ʊ�1���嶡�飨ͼ�ң�ʱȴ���ܱ߷�Ӧ�����������ԭ����_____��