题目内容
能正确表示下列反应的离子反应方程式为( )
| A、NH4HCO3溶液与过量的KOH溶液反应:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O |
| B、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓ |
| C、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| D、醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、两组离子都要和氢氧根离子反应,没有加热生成一水合氨;
B、1mol明矾电离出1mol的Al3+和2mol的硫酸根离子,要使2molSO42-恰好沉淀完全需2molBa2+,而产生2molBa2+的同时产生4molOH-,Al3+和OH-之比为1:4时生成AlO2-;
C、通入足量氯气,少的FeBr2溶液要符合组成之比;
D、醋酸为弱酸,应写成化学式,碳酸钙不溶于水,离子方程式中应写成化学式.
B、1mol明矾电离出1mol的Al3+和2mol的硫酸根离子,要使2molSO42-恰好沉淀完全需2molBa2+,而产生2molBa2+的同时产生4molOH-,Al3+和OH-之比为1:4时生成AlO2-;
C、通入足量氯气,少的FeBr2溶液要符合组成之比;
D、醋酸为弱酸,应写成化学式,碳酸钙不溶于水,离子方程式中应写成化学式.
解答:
解:A、两组离子都要和氢氧根离子反应,没有加热生成一水合氨,正确的离子方程式为NH4++HCO3-+2OH-=CO32-+NH3?H2O+H2O,故A错误;
B、1mol明矾电离出1mol的Al3+和2mol的硫酸根离子,要使2molSO42-恰好沉淀完全需2molBa2+,而产生2molBa2+的同时产生4molOH-,Al3+和OH-之比为1:4时生成AlO2-,正确的离子方程式为Al3++2SO42-+2Ba2++4OH -=AlO2-+2H2O+2BaSO4↓,故B错误;
C、通入足量氯气,少的FeBr2溶液要符合组成之比,正确的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C正确;
D、醋酸为弱酸,应写成化学式,碳酸钙不溶于水,离子方程式中应写成化学式,离子方程式为CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故D错误;
故选C.
B、1mol明矾电离出1mol的Al3+和2mol的硫酸根离子,要使2molSO42-恰好沉淀完全需2molBa2+,而产生2molBa2+的同时产生4molOH-,Al3+和OH-之比为1:4时生成AlO2-,正确的离子方程式为Al3++2SO42-+2Ba2++4OH -=AlO2-+2H2O+2BaSO4↓,故B错误;
C、通入足量氯气,少的FeBr2溶液要符合组成之比,正确的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C正确;
D、醋酸为弱酸,应写成化学式,碳酸钙不溶于水,离子方程式中应写成化学式,离子方程式为CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故D错误;
故选C.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
A、1个氢气分子的实际质量约为(
| ||
| B、含NA个氧原子的氧气在标准状况下的体积约为22.4L | ||
| C、过氧化钠与水反应,每产生标准状况下11.2L O2,转移NA个电子 | ||
| D、1mol Na 原子中含有NA个电子 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
| A、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B、I2+SO2+2H2O=H2SO4+2HI |
| C、H2O2+H2SO4=SO2↑+O2↑+2H2O |
| D、2Fe2++Cl2=2Fe3++2Cl- |
下列可以大量共存且溶液是无色的离子组是( )
| A、Al3+、NO3-、K+、SO42- |
| B、Ca2+、Na+、CO32-、AlO2- |
| C、OH-、SO42-、NH4+、Al3+ |
| D、Fe3+、Mg2+、NO3-、Cl- |
在某无色溶液中能大量共存的一组离子是( )
| A、H+、Ba2+、HCO3-、Cl- |
| B、K+、Fe3+、I-、NO3- |
| C、NH4+、AlO2-、Cl-、OH- |
| D、K+、SO42-、S2-、Cl- |
1mol  与Cu(OH)2作用,最多消耗Cu(OH)2( )
与Cu(OH)2作用,最多消耗Cu(OH)2( )
 与Cu(OH)2作用,最多消耗Cu(OH)2( )
与Cu(OH)2作用,最多消耗Cu(OH)2( )| A、2.5mol | B、2mol |
| C、3mol | D、4mol |
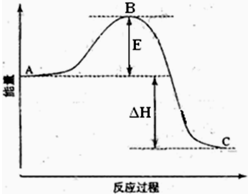 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: