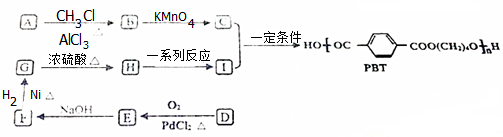
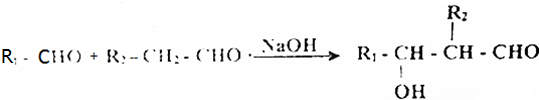题目内容
6.下列有关化学实验仪器的使用方法及操作正确的是( )| A. | 用规格为100mL的量筒量取89.7mL蒸馏水 | |
| B. | 用容量瓶配制一定物质的量浓度的溶液前需用标准液润洗 | |
| C. | 打开分液漏斗、长颈漏斗、滴液漏斗的活塞,均可放出其中液体 | |
| D. | 锥形瓶、烧杯、烧瓶均可垫加石棉网加热 |
分析 A.液体的体积应与选取量筒规格接近;
B.容量瓶不能用标准液润洗;
C.长颈漏斗没有活塞,
D.烧杯、烧瓶和锥形瓶均为间接加热仪器.
解答 解:A.液体的体积应与选取量筒规格接近,则用规格为100mL的量筒量取89.7mL蒸馏水,可减小误差,故A正确;
B.容量瓶不能用标准液润洗,若配制时用标准液润洗,浓度偏大,故B错误;
C.长颈漏斗没有活塞,打开分液漏斗、滴液漏斗的活塞,均可放出其中液体,故C错误
D.烧杯、烧瓶和锥形瓶均为间接加热仪器,则烧杯、烧瓶、锥形瓶均可加垫石棉网加热,故D正确;
故选AD.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器的使用、溶液配制等,把握常见仪器的结构及使用方法、实验基本操作等为解答的关键,注意操作失误导致的误差,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
16.战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )
| A. | CaO | B. | NaHCO3 | C. | SiO2 | D. | CaCO3 |
17.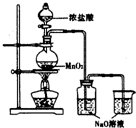 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
(1)写出利用上述装置制备消毒液涉及反应的化学方程式4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O、Cl2+2NaOH═NaClO+NaCl+H2O.
(2)盘阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性性.
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有人认为由操作b获得上述结论并不严谨.需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消 毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL0.5mol•L-1KI溶液,10mL2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.
 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(2)盘阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有人认为由操作b获得上述结论并不严谨.需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消 毒液在酸性条件下所能释放出氯气的质量”进行表征.一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:取此消毒液5g,加入20mL0.5mol•L-1KI溶液,10mL2mol•L-1的硫酸溶液;加几滴淀粉溶液后.用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟恢复.
②此消毒液有效氯含量为1.42%.
1.化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
| A. | 苯酚有一定毒性,不能作消毒剂和防腐剂 | |
| B. | 纤维素可水解成葡萄糖,人类可从中获得生存所需的能量 | |
| C. | 2014年1月,国家首次将雾霾天气纳入自然灾情进行通报,雾霾是一种不同于胶体的分散系,它的形成与大量焚烧田间秸秆有关 | |
| D. | 煤经气化和液化两个物理变化过程,可变为清洁能源 |
18.如表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍,下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 | |
| B. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| C. | XZ2、XW4与YW3都是非极性分子 | |
| D. | W的氧化物的水化物酸性一定比Z的强 |
15.在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重.这种材料难分解,处理麻烦.最近研制出了一种新材料: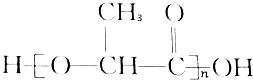 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
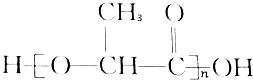 能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
能代替聚苯乙烯,它是由乳酸缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的单体是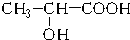 | ||
| C. | 聚乳酸是一种羧酸 | D. | 其聚合方式和乙烯相同 |
19.化学与生活、生产密切相关,下列说法错误的是( )
| A. | 大力防治 PM2.5 的污染防治,可减少雾霾天气 | |
| B. | “84 消毒液”具有强氧化性,可作环境的消毒剂 | |
| C. | 发展低碳经济,利用太阳能、风能实现城市照明 | |
| D. | 可以用福尔马林溶液保存海鲜产品 |
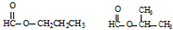 .
.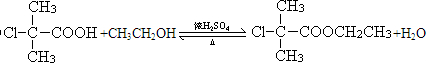 .
.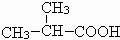 ;F
;F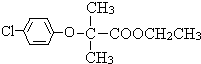 .
.