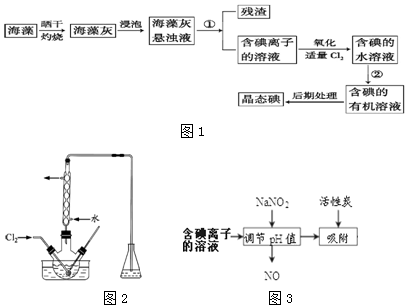
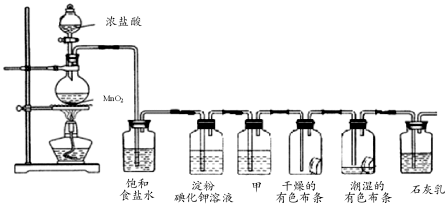
题目内容
8.有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若甲不变,将乙蒸发掉一半水(溶质不析出),丙中通入一定量的CO2.然后以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是( )| A. | V甲=V乙>V丙 | B. | V丙>V乙>V甲 | C. | V乙>V丙>V甲 | D. | V甲=V乙=V丙 |
分析 甲不变,乙蒸发掉一半水(溶质不析出),丙中通入一定量的CO2,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后溶液中的溶质均为NaCl,结合原子守恒计算.
解答 解:甲不变,乙蒸发掉一半水(溶质不析出),丙中通入一定量的CO2,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后溶液中的溶质均为NaCl,
等体积等物质的量浓度的NaOH溶液,n(NaOH)相同,
由原子守恒可知,n(NaOH)~n(NaCl)~n(HCl),
即消耗盐酸的物质的量相同,同浓度的盐酸,则消耗盐酸的体积相同,
故选D.
点评 本题考查离子反应的计算,为高频考点,侧重分析能力及计算能力的考查,把握反应后溶液中的溶质及原子守恒为解答的关键,利用守恒法可快速得到答案,简化计算过程,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
18.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA | |
| B. | 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA | |
| C. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| D. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA |
16.有甲、乙、丙三种溶液,进行如下操作:
Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀完全溶解并产生气体$\stackrel{丙}{→}$产生白色沉淀
则甲、乙、丙三种溶液可能是( )
Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀完全溶解并产生气体$\stackrel{丙}{→}$产生白色沉淀
则甲、乙、丙三种溶液可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | NaCl、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2SO4 |
3.化学与生活密切相关.下列有关说法正确的是( )
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 油脂和蛋白质都属于高分子化合物 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 医用消毒酒精中乙醇的浓度为95% |
13.关于SO2、CO2、MnO2三种物质,下列说法错误的是( )
| A. | 都含有氧元素 | B. | 都是化合物 | C. | 都是氧化物 | D. | 都含有氧分子 |
17.下列物质中,其水溶液能导电又属于非电解质的是( )
| A. | NH3 | B. | 蔗糖 | C. | 空气 | D. | 液态HC1 |