题目内容
4.已知A、B、C、D为中学化学中的常见气体,E、F为固体,G是氯化钙;A和B发生反应时产生苍白色火焰,并在空气中出现白雾;C和D发生反应时产生白烟.它们之间的转化关系如图所示: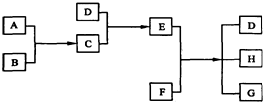
(1)D的分子式是NH3,E的分子式是NH4Cl.
(2)A和B反应生成C的化学方程式是H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
(3)E和F反应生成D、H和G的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2.
分析 G为氯化钙,由此推知E、F中必有一种物质为氯化物;D和C两种气体反应可生成固态E,进而逆推C为化合物,则A、B必为气体单质;A和B发生反应时产生苍白色火焰,并在空气中出现白雾,经猜想和假设C为HCl,则A、B为H2和Cl2;C(HCl)和D发生反应时产生白烟,D为NH3,E为NH4Cl;E、F反应能够生成D氨气、G氯化钙,结合实验室制取氨气可知F为Ca(OH)2,H为水,据此进行解答.
解答 解:G为氯化钙,由此推知E、F中必有一种物质为氯化物;D和C两种气体反应可生成固态E,进而逆推C为化合物,则A、B必为气体单质;A和B发生反应时产生苍白色火焰,并在空气中出现白雾,经猜想和假设C为HCl,则A、B为H2和Cl2;C(HCl)和D发生反应时产生白烟,D为NH3,E为NH4Cl;E、F反应能够生成D氨气、G氯化钙,结合实验室制取氨气可知F为Ca(OH)2,H为水,
(1)根据分析可知,D为NH3,E为NH4Cl,
故答案为:NH3;NH4Cl;
(2)A和B反应生成C的化学方程式是:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,
故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(3)E和F反应生成D、H和G的化学方程式是:,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2.
点评 本题考查了无机物的推断,题目难度中等,明确常见元素及其化合物性质为解答关键,注意正确利用题中突破口,如“苍白色火焰”、“白烟”“白雾”“G是氯化钙”等,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
14.分别用等体积、等浓度的AgNO3溶液跟相同体积的下列溶液恰好完全沉淀,则下列溶液中物质的量浓度最小的是( )
| A. | BaCl2 | B. | MgCl2 | C. | KCl | D. | FeCl3 |
15.用以下装置和试剂构成一个原电池(如图),下列叙述正确的是( )
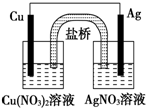

| A. | 将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同 | |
| B. | 该电池的负极反应为:Ag++e-═Ag | |
| C. | 在外电路中,电子由银电极流向铜电极 | |
| D. | 实验过程中取出盐桥,原电池仍继续工作 |
12.下列离子在溶液中能大量共存的是( )
| A. | HCO3-、NH4+、H+、Cl- | B. | AlO2-、OH-、Na+、Cl- | ||
| C. | AlO2-、H+、MnO4-、NO3- | D. | Mg2+、Fe3+、NO3-、OH- |
19.下列有关丙烯醛( CH2=CH-CHO)的叙述中,不正确的是( )
| A. | 可使溴水溶液褪色 | B. | 不能与酸性高锰酸钾溶液反应 | ||
| C. | 能发生银镜反应 | D. | 一定条件下能发生加聚反应 |
9.某无色溶液能与铝作用生成氢气,则溶液中可能大量共存的离子组是( )
| A. | H+、Fe2+、Mg2+、Cl- | B. | Cl-、CO32-、Cu2+、Mg2+ | ||
| C. | H+、NO3-、SO42-、K+ | D. | NO3-、OH-、Ba2+、Cl- |
16.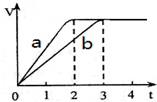 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图所示,下列说法正确的是( )| A. | 曲线a代表Al的反应过程,曲线b代表Mg的反应过程 | |
| B. | Mg和Al的质量之比为3:2 | |
| C. | Mg和Al的物质的量之比为3:2 | |
| D. | Mg和Al的反应速率之比为3:2 |