题目内容
5.常温下0.1mol•L-1的下列溶液中c(NH4+)最大的是( )| A. | NH4Al(SO4)2 | B. | NH4Cl | C. | NH3•H2O | D. | CH3COONH4 |
分析 根据盐的浓度先判断能电离出来的铵根离子浓度的大小,再根据离子水解的影响因素来确定铵根浓度的大小.
解答 解:NH4Al(SO4)2、NH4Cl、CH3COONH4均为强电解质,完全电离,NH3•H2O为弱电解质,部分电离;
在ABD三者中,B中铵根离子是正常的单水解,D中铵根离子的水解会受到促进,A中铵根离子的水解会受到铝离子水解生成的氢离子的抑制,所以A中NH4+离子的浓度最大.
故选A.
点评 本题考查了盐的电离以及弱离子水解的影响因素知识,注重学生对盐的水解实质的理解和掌握,难度不大,题目旨在训练学生对基础知识的应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.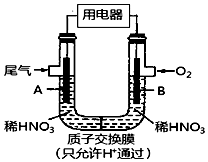 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
 某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )| A. | 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路 | |
| B. | 电极B附近的HNO3浓度增大 | |
| C. | A电极的反应为:NO2-e-+H2O═NO3-+2H+,NO-3e-+2H2O═NO3-+4H+ | |
| D. | 该电池工作时,每消耗11.2L O2(标准状况下),可以除去含1mol NO和NO2的混合尾气 |
16.仅用提供的硅酸盐仪器(非硅酸盐仪器任选),不能达到相应实验目的是( )
| A. | 提纯粗盐:烧杯、玻璃棒、酒精灯、蒸发皿、漏斗 | |
| B. | 中和热的测定:量筒、温度计、环形玻璃搅拌棒、胶头滴管 | |
| C. | 用CCl4提取碘水中的碘:分液漏斗、烧杯 | |
| D. | 用18.4 mol•L-1浓硫酸配制100mL 1.0 mol•L-1硫酸:10mL量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
13.化学在生活中有着广泛的应用,下列物质性质与应用对应关系错误的是( )
| A. | 硅胶吸水能力强,可作食品干燥剂 | |
| B. | CaO能与SO2反应,可作工业废气脱硫剂 | |
| C. | 聚四氟乙烯耐高温、耐腐蚀、不粘附、无毒害,可用于厨具表面涂层 | |
| D. | Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂 |
20.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| B. | 室温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA | |
| D. | 14g分子式为C3H6的链烃中含有的C-H键的数目为2NA |
8.下列实验装置、试剂选用或操作正确的是( )
| A. |  稀释浓硫酸 | B. |  吸收氨气 | C. |  石油的分馏 | D. |  除去CO2中的HCl |
9.下列说法正确的是( )
| A. | 氢氟酸、浓硝酸、硅酸钠溶液依次保存在棕色玻璃瓶、无色细口瓶、带胶塞细口瓶中 | |
| B. | 钠着火时不能用泡沫灭火器灭火 | |
| C. | 用饱和碳酸钠溶液除去CO2中混有的HCl | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |