题目内容
4.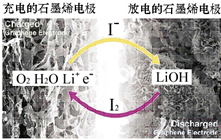 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH对于该电池的下列说法不正确的是( )
| A. | 放电时负极上I- 被氧化 | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 充电时阴极反应为LiOH+e-═Li+OH- | |
| D. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH |
分析 A、放电时,负极上发生失电子的氧化反应,元素的化合价升高;
B、充电时,电解质里的阳离子移向阴极,阴离子移向阳极;
C、充电时阴极发生得电子的还原反应;
D、放电时,正极上发生得电子的还原反应,据此书写电极反应式.
解答 解:A、放电时,负极上发生失电子的氧化反应,元素的化合价升高,根据总反应,得到I- 被氧化,故A正确;
B、充电时,电解质里的阳离子移向阴极,故B正确;
C、充电时阴极发生得电子的还原反应,应该是碘单质得电子的还原反应,故C错误;
D、放电时,正极上发生得电子的还原反应,正极反应为O2+2H2O+4Li++4e-═4LiOH,故D正确.
故选C.
点评 本题以新型电池为载体考查原电池和电解池原理,明确原电池和电解池电极上得失电子即可解答,注意电极方程式的书写是关键.

练习册系列答案
相关题目
15.下列叙述正确的是( )
| A. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| B. | 20 mL 0.1 mol/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后的溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L | |
| C. | 浓度均为1 mol/L的以下溶液:①醋酸 ②NaOH溶液 ③盐酸 ④醋酸钠溶液,其水的电离程度的关系为:④>①>③>② | |
| D. | 相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液一定存在关系:c(CH3COO-)=c(HCO3-)+2c(CO32-) |
12.下列离子方程式中,不正确的是( )
| A. | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
19.水的摩尔质量和1mol水的质量分别是( )
| A. | 18,18 | B. | 18g,18g | C. | 18g/mol,18g | D. | 18g,18g/mol |
16.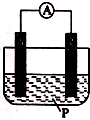 如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
 如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
如图所示装置中,可观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )| 选项 | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 锌 | 稀盐酸 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关氮元素及其化合物的表示正确的是( )
| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 溴化铵的电子式: | |
| C. | 氮原子的结构示意图: | |
| D. | 间硝基甲苯的结构简式: |
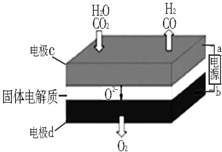 综合利用CO2、CO对构建低碳社会有重要意义.
综合利用CO2、CO对构建低碳社会有重要意义.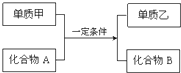 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题: