题目内容
(13分)综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
A.可在酸性氧化物中寻找 B.可在碱性氧化物中寻找
C.可在ⅠA、ⅡA族元素形成的氧化物中寻找 D.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A: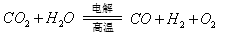 已知:
已知:
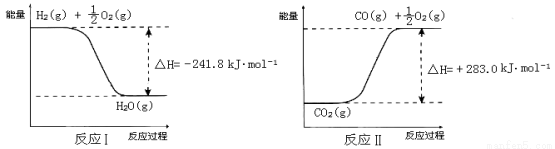
① 反应Ⅱ是_____反应(填“吸热”或“放热”)。
② 反应A的热化学方程式是 。
(4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3  Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
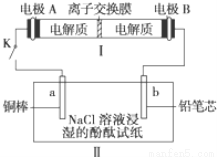
①负极反应式为:
②当有0.02 mol Na+通过离子交换膜时,b电极上析出的气体体积为 mL
③闭合K后,b电极附近的pH (填变大、变小或不变);
同时a电极反应式为
1)B、C(1分);(2)CO2 + Li4SiO4  Li2CO3 + Li2SiO3(2分)
Li2CO3 + Li2SiO3(2分)
(3)① 吸热 (1分); ② CO2(g) + H2O(g) ==CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1(2分)
(4) ① 2Na2S2 – 2e- =2 Na+ + Na2S4 (2分)② 224ml(2分);③变大(1分),Cu – 2e- = Cu2+(2分)
【解析】
试题分析:由于CO2是酸性氧化物,所以如果要寻找吸收CO2的其他物质,应该在可在碱性氧化物中寻找或者可在ⅠA、ⅡA族元素形成的氧化物中寻找,故选项是B、C。(2)根据题意可得:CO2 + Li4SiO4  Li2CO3 + Li2SiO3;(3)由于生成物的能量高于反应物,所以发生的该反应是吸热反应;② 将反应Ⅱ的热化学方程式减去反应Ⅰ的热化学方程式,整理可得反应A的热化学方程式是CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g) ΔH=+524.8KJ/mol;(4)闭合开关K时,b极附近先变红色。则在b电极上溶液中的H+放电,附近的水电离溶液显碱性,所以b是阴极,a是阳极。则电源电极A是正极,B是负极。①在负极B上Na2S2失去电子,发生氧化反应,电极反应式为:2Na2S2 – 2e- =2 Na+ + Na2S4 ;②当有0.02 mol Na+通过离子交换膜时,电子转移0.02mol,则在b电极上有0.02mol的H+放电产生氢气,析出的气体是0.01mol,体积为0.224L=224ml. ③闭合K后,由于在阴极b电极H+放电,破坏了附近的水的电离平衡,水会继续电离,直至建立新的平衡,最终由于附近c(OH-)>c(H+),所以碱性增强,附近的pH增大;同时阳极a电极材料是Cu,是活性电极,电极本身失去电子,发生氧化反应,电极反应式为Cu – 2e- = Cu2+。
Li2CO3 + Li2SiO3;(3)由于生成物的能量高于反应物,所以发生的该反应是吸热反应;② 将反应Ⅱ的热化学方程式减去反应Ⅰ的热化学方程式,整理可得反应A的热化学方程式是CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g) ΔH=+524.8KJ/mol;(4)闭合开关K时,b极附近先变红色。则在b电极上溶液中的H+放电,附近的水电离溶液显碱性,所以b是阴极,a是阳极。则电源电极A是正极,B是负极。①在负极B上Na2S2失去电子,发生氧化反应,电极反应式为:2Na2S2 – 2e- =2 Na+ + Na2S4 ;②当有0.02 mol Na+通过离子交换膜时,电子转移0.02mol,则在b电极上有0.02mol的H+放电产生氢气,析出的气体是0.01mol,体积为0.224L=224ml. ③闭合K后,由于在阴极b电极H+放电,破坏了附近的水的电离平衡,水会继续电离,直至建立新的平衡,最终由于附近c(OH-)>c(H+),所以碱性增强,附近的pH增大;同时阳极a电极材料是Cu,是活性电极,电极本身失去电子,发生氧化反应,电极反应式为Cu – 2e- = Cu2+。
考点:考查物质的性质及应用、热化学方程式的书写、原电池、电解池的电极判断、电极反应式的书写。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案(15分)银氨溶液可用于检测CO气体,实验室研究的装置如图:
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。

 2H2SO4
2H2SO4 H2CO3+2OH?
H2CO3+2OH? 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 