题目内容
25 ℃时,浓度为0.2 mol/L的NaHCO3溶液中,下列判断不正确的是( )
A.存在电离平衡HC  H++C H++C |
B.存在水解平衡HC +H2O +H2O H2CO3+OH- H2CO3+OH- |
| C.将溶液加热蒸干、灼烧得Na2O2固体 |
D.加入NaOH固体,恢复到原温度,c(OH-)、c(C )均增大 )均增大 |
C
解析

练习册系列答案
相关题目
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是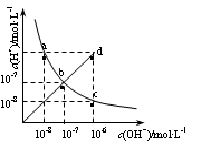
| A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14 |
| B.b d线段上任意一点对应的溶液都呈中性 |
| C.d点对应溶液的温度高于25℃,pH<7 |
| D.CH3COONa溶液不可能位于c点 |
下列说法正确的是( )
| A.常温下,醋酸钠与醋酸的混合溶液PH=7,C(Na+)>c(CH3COO-) |
| B.0.1mol/LNa2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C.将PH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-) |
| D.0.1mol/LNaHCO3溶液中:c(Na+)+c(H+)= c(HCO3-)+ c(OH-)+2c(CO32-) |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。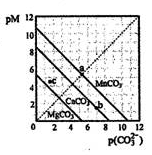
已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-)。下列说法正确的是
| A.MgCO3、CaCO3、MnCO3的KSP依次增大 |
| B.a点可表示 MnCO3的饱和溶液,且c(Mn2+)=c(CO32-) |
| C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) |
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
| A.若a=b,则c(NH4+)=c(Cl-) |
| B.若a>b,则c(NH4+)>c(Cl-) |
| C.若a>b,则c(OH-)>c(H+) |
| D.若a<b,则c(OH-)<c(H+) |
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是( )
| A.①点溶液中c(H+)为0.200 mol·L-1 |
| B.溶液温度高低为①>③>② |
| C.③点溶液中有c(Cl-)>c(CH3COO-) |
| D.③点后因离子数目减少使溶液电导率略降低 |
室温时,M(OH)2(s) M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于( )
M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于( )
A. lg( lg( ) ) | B. lg( lg( ) ) |
C.14+ lg( lg( ) ) | D.14+ lg( lg( ) ) |
313 K时,水的Kw=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液( )
| A.呈酸性 | B.呈中性 | C.呈碱性 | D.无法判断 |
