题目内容
二氧化碳(ClO2)为一种黄绿色气体,是一种高效、广谱、安全的杀菌消毒剂,制备ClO2的方法有多种.
(1)纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物A与NaClO3反应生成ClO2完成反应的化学方程式:
□ +24NaCl03+12H2SO4═□ClO2↑+□CO2↑+18H2O+□
(2)电解食盐水制取ClO2,其流程图如下:
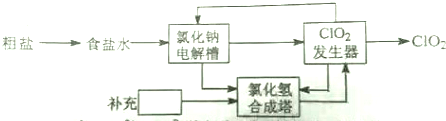
①粗盐中含有Ca2+、Mg2+、SO42-等杂质,除杂操作时,往粗盐水中加入试剂的顺序依次为 (填化学式)充分反应后将沉淀一并滤去,在加入盐酸.
②食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸在发生器中反应生成ClO2,写出发生器中生成ClO2的化学方程式:
③上述流程中,可循环利用的物质有 ;按照绿色化学原则,电解槽阴极的产物 .
(1)纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物A与NaClO3反应生成ClO2完成反应的化学方程式:
□
(2)电解食盐水制取ClO2,其流程图如下:

①粗盐中含有Ca2+、Mg2+、SO42-等杂质,除杂操作时,往粗盐水中加入试剂的顺序依次为
②食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸在发生器中反应生成ClO2,写出发生器中生成ClO2的化学方程式:
③上述流程中,可循环利用的物质有
考点:电解原理
专题:电化学专题
分析:(1)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到;
(2)①碳酸钠可以将钙离子以及过量的钡离子沉淀下来;除镁离子用氢氧化钠,除钙离子用碳酸钠,除硫酸根离子用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠必须放在氯化钡的后面;
②根据流程图可知道:食盐水在特定条件下电解得到氯酸钠(NaClO3),NaClO3和HCl反应,生成ClO2,可以写出方程式;
③根据流程中物质的转化确定可以循环使用的物质,电解池的阴极上是氢离子得电子的还原反应.
(2)①碳酸钠可以将钙离子以及过量的钡离子沉淀下来;除镁离子用氢氧化钠,除钙离子用碳酸钠,除硫酸根离子用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠必须放在氯化钡的后面;
②根据流程图可知道:食盐水在特定条件下电解得到氯酸钠(NaClO3),NaClO3和HCl反应,生成ClO2,可以写出方程式;
③根据流程中物质的转化确定可以循环使用的物质,电解池的阴极上是氢离子得电子的还原反应.
解答:
解:(1)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4,
故答案为:1;C6H12O6;24;6;12;Na2SO4;
(2)①有效除去Ca2+、Mg2+、Fe3+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,而Mg2+、Fe3+、SO42-除杂不分先后,则试剂加入顺序为NaOH-BaCl2-Na2CO3或BaCl2-NaOH-Na2CO3,
故答案为:BaCl2、Na2CO3、NaOH(或NaOH、BaCl2、Na2CO3);
②电解食盐水得到氯酸钠(NaClO3)和H2,NaClO3和盐酸发生歧化反应,生成NaCl、2ClO2、Cl2、H2O,化学方程式为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,故答案为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
③可以循环使用的物质有Cl2、NaCl,电解池的阴极上是氢离子得电子的还原反应,产生的是氢气,故答案为:Cl2、NaCl;氢气.
故答案为:1;C6H12O6;24;6;12;Na2SO4;
(2)①有效除去Ca2+、Mg2+、Fe3+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,而Mg2+、Fe3+、SO42-除杂不分先后,则试剂加入顺序为NaOH-BaCl2-Na2CO3或BaCl2-NaOH-Na2CO3,
故答案为:BaCl2、Na2CO3、NaOH(或NaOH、BaCl2、Na2CO3);
②电解食盐水得到氯酸钠(NaClO3)和H2,NaClO3和盐酸发生歧化反应,生成NaCl、2ClO2、Cl2、H2O,化学方程式为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,故答案为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
③可以循环使用的物质有Cl2、NaCl,电解池的阴极上是氢离子得电子的还原反应,产生的是氢气,故答案为:Cl2、NaCl;氢气.
点评:本题通过化学工艺流程,考查了氧化还原反应相关概念、配平及计算,化学实验基本方法(除杂),电解原理,综合性强,题目难度中等,对于该类题目的处理,注意看清工艺流程的目的,分析工艺流程的过程,寻找与所学知识的结合点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3)反应原理是:2FeSO4
Fe2O3+SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,依次将气体通过盛有(Ⅰ)BaCl2溶液、(Ⅱ)X溶液、(Ⅲ)NaOH溶液的三个装置.则下列对该方案的评价中正确的是( )
| ||
| A、(Ⅰ)中会生成BaSO3、BaSO4两种沉淀 |
| B、可将(Ⅰ)中的BaCl2溶液改为Ba(NO3)2溶液 |
| C、(Ⅱ)所盛X应为品红溶液 |
| D、(Ⅲ)的作用是检验生成的SO2气体 |
香烟烟雾中含有CO、CO2、SO2、H2O等气体,用①无水CuSO4 ②澄清石灰水 ③红热CuO ④生石灰 ⑤品红溶液 ⑥酸性高锰酸钾溶液等药品可将其一一检出,检测时香烟烟雾通入药品的正确顺序是( )
| A、①-⑤-②-⑥-④-③ |
| B、①-⑤-⑥-②-④-③ |
| C、③-④-②-⑥-⑤-① |
| D、②-⑤-①-④-③-⑥ |
下面是用电子式表示某些物质的形成过程,其中正确的是( )
A、 |
B、 |
C、 |
D、 |
下列说法中正确的是( )
| A、氢键是一种特殊的化学键,它广泛地存在于自然界中 |
| B、正四面体分子的键角都为109°28ˊ |
| C、由分子构成的物质中一定含有共价键 |
| D、形成共价键的元素不一定是非金属元素 |

 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.