题目内容
17.利用CH4和O2的反应,在KOH溶液中用铂作电极可以构成原电池.下列说法正确的是( )①每消耗1molCH4可以向外电路提供8mole-
②在负极上O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-
③外电路电子由负极流向正极,内电路电子由正极流向负极
④电池放电过程中,溶液的PH不断降低
⑤负极发生氧化反应,正极发生还原反应
⑥负极附近会出现淡蓝色火焰.
| A. | ①④⑤ | B. | ①③④ | C. | ②③⑥ | D. | ②⑤⑥ |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,原电池工作时,电子从负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动
解答 解:①通入CH4的电极为负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,每消耗1molCH4可以向外电路提供8mole-;故①正确;
②在正极上O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-,故②错误;
③外电路电子由负极流向正极,内电路电子不能流动,故③错误;
④电池反应式为:CH4+2OH-+2O2=CO32-+3H2O,随着反应的进行,溶液中氢氧根离子不断减少,溶液pH不断减小,故④正确;
⑤负极发生氧化反应,正极发生还原反应,故⑤正确;
⑥负极附近不可能看到燃烧的现象,故不会出现淡蓝色火焰,故⑥错误.
故选:A.
点评 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累电子、电流、离子的流向.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
7.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A. | 1g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4L O2含有的分子数目为NA | |
| C. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 1molZn变为Zn2+失去的电子数目为NA |
8. 通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
(1)比较下列物质的熔点高低(填“>”或“<”):SiCl4<SiO2,原因是SiCl4为分子晶体,SiO2为原子晶体.
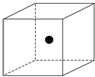
(2)图中立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g);
1mol晶体硅中含2molSi-Si键;该反应的反应热△H=+236kJ•mol-1.
 通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列物质的熔点高低(填“>”或“<”):SiCl4<SiO2,原因是SiCl4为分子晶体,SiO2为原子晶体.
(2)图中立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g);
1mol晶体硅中含2molSi-Si键;该反应的反应热△H=+236kJ•mol-1.
2.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
| B | C |
| D |
| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | A、D、E均可形成两种常见氧化物 |
9.NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,78 g 固体Na2O2中,含有的阴阳离子总数为4 NA | |
| B. | 标准状况下,4.48L HF分子中含0.2NA个H-F键 | |
| C. | 常温常压下,8gO2含有8NA个电子 | |
| D. | 4℃时,20 g 2H216O中含有共用电子对数为2 NA |
6.下列性质的递变规律不正确的是( )
| A. | NaOH、KOH、CsOH碱性依次增强 | |
| B. | Li、Na、K、Rb、Cs单质的失电子能力逐渐增强 | |
| C. | Al、Mg、Na的原子半径依次减小 | |
| D. | Li、Na、K、Rb、Cs原子半径依次增大 |
 互为同分异构体且属于芳香烃的分子的结构简式:
互为同分异构体且属于芳香烃的分子的结构简式: ;
;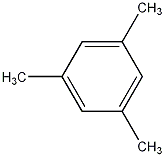 、
、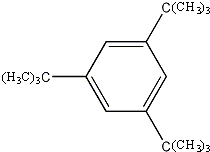 .
.