题目内容
6.下列离子方程式正确的是( )| A. | 稀硝酸中加入少量铁粉:Fe+2H++NO3-═Fe3++NO↑+H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2使溶液呈中性:SO42-+Ba2++2OH-+2H+═BaSO4↓+2H2O | |
| C. | FeI2溶液中加入少量的氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 碳酸氢钠溶液加入少量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
分析 A.稀硝酸中加入少量铁粉,硝酸过量,生成硝酸铁、NO和水,方程式左右电荷不守恒;
B.向NaHSO4溶液中滴加Ba(OH)2使溶液呈中性,反应生成硫酸钡和水;
C.向FeI2溶液中加入氯水,氯气先和碘离子发生置换反应,然后再和亚铁离子发生反应,FeI2溶液中加入少量的氯水,只氧化碘离子;
D.碳酸氢钠溶液加入少量石灰水,碳酸氢钠足量,反应生成碳酸钙、碳酸钠和水.
解答 解:A.向稀硝酸中加入少量铁粉,硝酸过量,生成硝酸铁,离子反应为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故A错误;
B.向NaHSO4溶液中加入Ba(OH)2使溶液呈中性,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B正确;
C.向FeI2溶液中加入少量的氯水,氯气只和碘离子发生置换反应,离子方程式:2I-+Cl2=2Cl-+I2,故C错误;
D.少量氢氧化钙溶液中加入足量的碳酸氢钠溶液反应生成碳酸钙、碳酸钠和水,离子方程式:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写,为高考频考点,熟悉反应实质及离子方程式书写方法是解题关键,注意反应的量与反应产物的关系,为易错点,题目难度中等.

练习册系列答案
相关题目
3.从人类生存环境和社会可持续发展的角度考虑,最理想的一种燃料是)( )
| A. | 甲烷 | B. | 煤 | C. | 汽油 | D. | 氢气 |
4.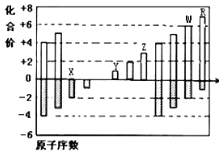 如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )
如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )
 如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )
如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )| A. | 原子半径:W>Z>Y | |
| B. | 气态氢化物的稳定性:H2X<H2W | |
| C. | Y2X和水反应能生成离子化合物 | |
| D. | Y和Z两者氧化物对应的水化物不能相互反应 |
1.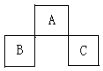 A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )
 A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期的元素,它们在周期表的位置如图.已知:B、C元素的原子序数之和是A 元素的原子序数的4倍,则A、B、C分别是( )| A. | Be、Na、Al | B. | O、P、Cl | C. | P、O、Cl | D. | C、Al、P |
1.下列叙述不正确的是( )
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 稀HNO3氧化能力弱于浓HNO3 | |
| C. | 贮存铵态氮肥时要密封保存,并放在阴凉处 | |
| D. | 硝酸只能被Zn、Fe等金属还原成H2 |
11.关于氯气的叙述正确的是( )
| A. | 通常情况下氯气呈黄绿色,有刺激性气味,极易溶于水 | |
| B. | 氯气能够杀菌,常用于居室消毒 | |
| C. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| D. | 把集气瓶小心地放在鼻孔下直接闻氯气的气味 |
18.下列变化不需要破坏化学键的是( )
| A. | 加热氯化铵 | B. | 水通电分解 | C. | 氯化氢溶于水 | D. | 冰融化成水 |
15.下列电子层中,原子轨道的数目为4的是( )
| A. | K 层 | B. | L层 | C. | M 层 | D. | N层 |
16.对下列实验现象解释正确的是( )
| 实验内容 | 实验现象 | 相关解释 | |
| A | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
| B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
| C | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
| D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | NO2有助燃性 |
| A. | A | B. | B | C. | C | D. | D |