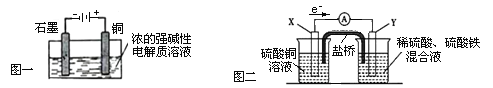
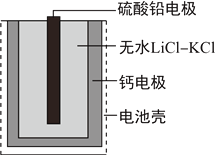
题目内容
【题目】当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
A.MgCl2B.NaOHC.MgSO4D.H2SO4
【答案】D
【解析】
根据平衡移动原理及溶度积解答,要使Mg(OH)2固体的量减少,即平衡向右移动,可以加水,或降低Mg2+或OH-的浓度;
A、少量MgCl2,Mg2+浓度增大,故平衡左移,Mg(OH)2固体的量增多,故A错误;
B、加入NaOH,OH-的浓度增大,平衡向左移动,Mg(OH)2固体的量增大,故B错误;
C、加入少量MgSO4,Mg2+的浓度增大,平衡左移,Mg(OH)2固体的量增大,故C错误;
D、加入少量的H2SO4,H2SO4电离出氢离子结合OH-,OH-的浓度减小,平衡向右移动,Mg(OH)2固体的量减小,故D正确;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)分别取40 mL 0.50 mol/L盐酸与0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。实验时,还需测量的数据有_______________。
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(2)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为△H=____________。
(3)假定该学生的操作完全同上,实验中改用100 mL0.50 mol/L盐酸跟100 mL 0.55 mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”)所求中和热___________________(填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会__________(填“偏大”、“偏小”或“无影响”);用40 mL0.50 mol/LNaOH溶液进行上述实验,测得的中和热数值会__________。(填“偏大”、“偏小”或“无影响”)
(5)上述实验结果与57.3 kJ/mol(常温下中和热的值)有偏差,产生偏差的原因可能是(填字母)___________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
c.用量筒量取盐酸溶液的体积时仰视读数
d.分多次把NaOH溶液倒入盛有盐酸的小烧杯
【题目】溶液中同时存在![]() 和
和![]() 四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
物质 | 溶度积( |
|
|
|
|
|
|
|
|
A.Al3+最先转化为Al(OH)3沉淀
B.加碱过程中,![]() 几乎同时转化为沉淀
几乎同时转化为沉淀
C.要使Mg2+转化为沉淀,溶液pH应大于9
D.![]() 时,四种金属离子全部以沉淀形式存在
时,四种金属离子全部以沉淀形式存在