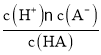题目内容
【题目】下列液体均处于25℃,有关叙述正确的是
A. 某物质的溶液pH<7,则该物质属于酸或强酸弱碱盐
B. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C. pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
D. AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
【答案】B
【解析】
A、室温下,溶液呈酸性,呈酸性的原因可能是酸电离或强酸弱碱盐水解或弱酸弱碱盐水解,也可能是强酸的酸式盐,如NaHSO4等,故A错误;
B、pH=4.5的番茄汁中c(H+)=10-4.5mol/L,pH=6.5的牛奶中c(H+)=10-6.5mol/L,10-4.5mol/L÷10-6.5mol/L=100,故B正确;
C、CH3COOH与CH3COONa混合溶液中,存在离子有:Na+、H+、CH3COO-、OH-,由电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈酸性,c(H+)>c(OH-),所以,c(Na+)<c(CH3COO-),故C错误;
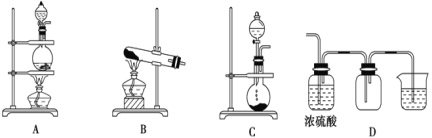
D、一定温度下AgCl的溶度积Ksp(AgCl)=c(Ag+)c(Cl-)是定值,c(Ag+)=![]() ,同浓度的CaCl2和NaCl溶液中,Cl-浓度前者是后者的2倍,所以AgCl在NaCl溶液中的溶解度更大,故D错误;
,同浓度的CaCl2和NaCl溶液中,Cl-浓度前者是后者的2倍,所以AgCl在NaCl溶液中的溶解度更大,故D错误;
答案选B。

【题目】工业上将苯的蒸气通过赤热的铁合成一种可作传热载体的化合物,该化合物分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时最多消耗6mol氢气,判断这种化合物可能是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. 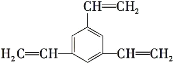
【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
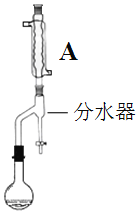
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是________。
(2)步骤2中,图中所示装置中仪器A的名称是______,其作用为_______。
(3)步骤3中,用5%Na2CO3溶液洗涤后,分离有机相的操作名称为_______,分离有机相时不需要用到下列玻璃仪器中的_______(填名称)。
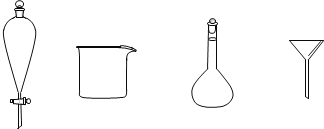
(4)实验中可能生成的有机副产物结构简式为_______ (填一种即可)。
(5)本实验中丙烯酸甲酯的产率为______%。