题目内容
已知CO、CO2的混合气体质量共10g,标准状况下体积为6.72L,试求混合气体中CO、CO2的质量及体积比.
解:标准状况下,n= =0.3mol,
=0.3mol,
设混合气体中CO的物质的量为x,CO2的物质的量为y,
则有:
解之得:x=0.2mol,y=0.1mol,
则:m(CO)=0.2mol×28g/mol=5.6g,V(CO)=0.2mol×22.4L/mol=4.48L,
m(CO2)=0.1mol×44g/mol=4.4g,V(CO2)=0.1mol×22.4L/mol=2.24L,
所以:m(CO):m(CO2)=5.6g:4.4g=14:11,V(CO):V(CO2)=4.48L:2.24L=2:1,
答:混合气体中CO、CO2的质量比为14:11,体积比为2:1.
分析:根据混合气体的体积可计算出总物质的量,根据总物质的量和总质量列式计算可得CO、CO2的物质的量,进而计算各自的质量和体积,可计算出混合气体中CO、CO2的质量及体积比.
点评:本题考查混合物的计算,题目难度不大,注意物质的量与质量、体积的计算公式的运用.
 =0.3mol,
=0.3mol,设混合气体中CO的物质的量为x,CO2的物质的量为y,
则有:

解之得:x=0.2mol,y=0.1mol,
则:m(CO)=0.2mol×28g/mol=5.6g,V(CO)=0.2mol×22.4L/mol=4.48L,
m(CO2)=0.1mol×44g/mol=4.4g,V(CO2)=0.1mol×22.4L/mol=2.24L,
所以:m(CO):m(CO2)=5.6g:4.4g=14:11,V(CO):V(CO2)=4.48L:2.24L=2:1,
答:混合气体中CO、CO2的质量比为14:11,体积比为2:1.
分析:根据混合气体的体积可计算出总物质的量,根据总物质的量和总质量列式计算可得CO、CO2的物质的量,进而计算各自的质量和体积,可计算出混合气体中CO、CO2的质量及体积比.
点评:本题考查混合物的计算,题目难度不大,注意物质的量与质量、体积的计算公式的运用.

练习册系列答案
相关题目
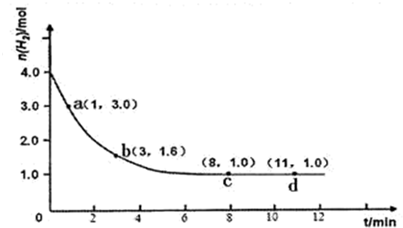

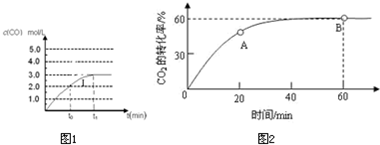

 CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g) CO2+H2;
CO2+H2; O2(g)═CO2(g)△H=-283.0KJ/mol;
O2(g)═CO2(g)△H=-283.0KJ/mol; O2(g)=H2O(g)△H=-285.8KJ/mol;
O2(g)=H2O(g)△H=-285.8KJ/mol;
 CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g) CO2+H2;
CO2+H2; O2(g)═CO2(g)△H=-283.0KJ/mol;
O2(g)═CO2(g)△H=-283.0KJ/mol; O2(g)=H2O(g)△H=-285.8KJ/mol;
O2(g)=H2O(g)△H=-285.8KJ/mol;