题目内容
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol
CO(g)+
O2(g)=CO2(g)△H=-282.5kJ/mol
假如标准状况下由CH4、CO、CO2组成的89.6L混和气体完全燃烧时能放出1010kJ的热量,并生成18g液态水,那么燃烧前混和气体中CO所占的体积百分含量为( )
CO(g)+
| 1 |
| 2 |
假如标准状况下由CH4、CO、CO2组成的89.6L混和气体完全燃烧时能放出1010kJ的热量,并生成18g液态水,那么燃烧前混和气体中CO所占的体积百分含量为( )
分析:根据生成18g液态水来确定混合气体中甲烷的物质的量,进而求得甲烷燃烧生成二氧化碳的量以及所放出的热量,据能量总和可以求出一氧化碳放出的热量,并求得一氧化碳的量以及CO所占的体积百分含量.
解答:解:生成18g即1mol液态水,则混合气体中含有的甲烷的物质的量是0.5mol,燃烧会放出的能量为445kJ,混和气体完全燃烧时能放出1010kJ的热量,所以一氧化碳共放出的能量为565kJ,所以一氧化碳的物质的量是2mol,CH4、CO、CO2组成的89.6L混和气体共4mol,所以
×100%=50%.
故选:B.
| 2 |
| 4 |
故选:B.
点评:本题考查学生热化学方程式中,热量和方程式的系数之间的关系知识,注意知识的迁移和应用是关键,难度不大.

练习册系列答案
相关题目
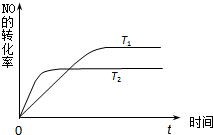 ①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”)
①由此推知,反应 N2(g)+O2(g)?2NO(g)为(填“吸热”或“放热”)