题目内容
20.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 用图甲所示装置提纯氢氧化铁胶粒 | |
| B. | 用图乙所示装置进行中和热的测定 | |
| C. | 用图丙所示装置验证温度对平衡移动的影响 | |
| D. | 用图丙所示装置除去乙醇中的乙醚 |
分析 A.胶体粒子透过滤纸;
B.缺少环形玻璃棒;
C.2NO2(g)?N2O4(g)△H<0,该反应的正反应是放热反应,升高温度平衡逆向移动,降低温度平衡正向移动;
D.乙醇、乙醚的沸点不同,可蒸馏分离.
解答 解:A.应用渗析的方法分离胶体和溶液,胶体粒子透过滤纸,用过滤的方法起不到分离的目的,故A错误;
B.测量中和热时,应用玻璃棒搅拌,以使反应迅速进行,缺少环形玻璃棒,故B错误;
C.2NO2(g)?N2O4(g)△H<0,该反应的正反应是放热反应,升高温度平衡逆向移动气体颜色加深,降低温度平衡正向移动,气体颜色变浅,故C正确;
D.乙醇、乙醚的沸点不同,可蒸馏分离,但题中图缺少加热装置,不能完成实验,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握常见物质的性质、混合物分离方法及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
9.下列应用不涉及物质氧化性或还原性的是( )
| A. | 用葡萄糖制镜或保温瓶胆 | |
| B. | 用漂白液杀菌、消毒 | |
| C. | 用Na2SiO3溶液制备木材防火剂 | |
| D. | 用浸泡过高锰酸钾的硅藻土保鲜水果 |
17.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{Ba(NO_{3})_{2}}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{电解}{→}$Mg | |
| D. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
8.某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1)取1mol•L-1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是SO32-+H2O?HSO3-+OH-.
②t时间段内,造成其pH发生上述变化,用离子方程式解释是2SO32-+O2=2SO42-.
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
实验ⅱ
①实验ⅱ证明,溶液中含有SO42-离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+,W溶液中c(Fe2+)一定很大,反应的离子方程式是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+.
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色.
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是4Fe2++O2+4H+=4Fe3++2H2O.
②实验过程和结果显示,O2、Fe3+、SO42-的氧化性强弱顺序是O2>Fe3+>SO42- O2>Fe3+>SO42-,.
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是8FeCl3+10Na2SO3+5O2+4H2O=2Fe4(OH)2(SO4)5+20NaCl+4HCl.
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+.
(1)取1mol•L-1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是SO32-+H2O?HSO3-+OH-.
②t时间段内,造成其pH发生上述变化,用离子方程式解释是2SO32-+O2=2SO42-.
(2)探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
| 装置 | 操作 | 现象 |
 | 向2mL1mol•L-1FeCl3溶液中,逐滴滴加1mo•L-1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
| 装置 | 操作 | 现象 |
 | 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+,W溶液中c(Fe2+)一定很大,反应的离子方程式是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+.
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色.
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是4Fe2++O2+4H+=4Fe3++2H2O.
②实验过程和结果显示,O2、Fe3+、SO42-的氧化性强弱顺序是O2>Fe3+>SO42- O2>Fe3+>SO42-,.
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是8FeCl3+10Na2SO3+5O2+4H2O=2Fe4(OH)2(SO4)5+20NaCl+4HCl.
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+.
15.下列化学方程式或离子方程式正确的是( )
| A. | 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| B. | 乙醇溶液中加入新制碱性Cu(OH)2悬浊液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| C. | 乙醇和浓硫酸混合加热至140℃:CH3CH2OH$→_{140℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| D. | 向小苏打溶液中加入醋酸:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- |
5.下列实验装置能达到相应目的是( )
| A. | 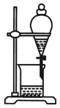 分离甘油和水 | B. | 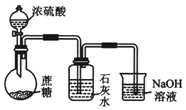 检验蔗糖与浓硫酸反应产生的CO2 | ||
| C. | 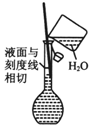 配制溶液 | D. | 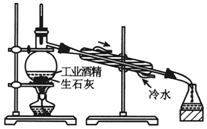 用工业酒精制取无水酒精 |
12.下列解释事实的方程式正确的是( )
| A. | 电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ | |
| B. | 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32-+Ca2+═CaCO3↓ | |
| C. | 向H2O2溶液中滴加CuSO4溶液,产生气泡:H2O2═H2O+O2↑ | |
| D. | 向苯酚浊液中滴加Na2CO3溶液,溶液变澄清: |
9.下列关于有机化合物的说法不正确的是( )
| A. | 可以用新制的氢氧化铜悬浊液(可加热)鉴别乙醇、乙酸和葡萄糖 | |
| B. | 苹果酸的结构简式为HOOCCH(OH)CH2COOH,则该物质可发生氧化、酯化、缩聚反应 | |
| C. | -C3H7和-C2H5O各取代苯分子中的一个氢原子形成的二元取代物共有24种 | |
| D. | 高分子化合物  的单体是CH2=CH2和C2H5COOH 的单体是CH2=CH2和C2H5COOH |
10.实验室用KClO3在MnO2催化下受热分解制取少量O2,并回收KCl,下列装置不能达实验目的是( )
| A. | 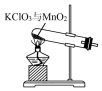 制取氧气 | B. | 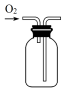 收集氧气 | C. | 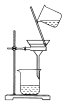 分离出MnO2 | D. |  蒸发结晶得KCl |