题目内容
| |||||||||||||||||||||
解析:
|
0.28 1.8 mol/L(无单位或单位错误不给分) |

| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
在80℃时,将0.4 mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.24 | 0.24 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0-20s内N2O4的平均反应速率为 。
(3)N2O4(g)![]() 2NO2(g)的平衡常数表达式K= ,在80℃时该反应的平衡常数K的数值为 。
2NO2(g)的平衡常数表达式K= ,在80℃时该反应的平衡常数K的数值为 。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A、N2O4的转化率越高 B、N2O4的体积分数越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
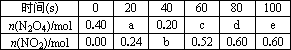
 在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4?2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:

