题目内容
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO ? Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3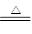 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:_______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
(1)Al2O3+Na2CO3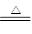 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(2)NaFeO2+2H2O=Fe(OH)3↓+NaOH
(3)由于溶液中硅酸钠和偏铝酸钠发生水解,降低pH有利于水解平衡向正方向移动,当pH调到7~8时,使它们水解完全,从而除去SiO32-和AlO2-。
(4)2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
(5)94.08%
解析试题分析:(1)Al2O3与Na2CO3生成可溶性盐,则应为NaAlO2,根据原子守恒另一种产物为CO2。
(2)NaFeO2水解产生沉淀,则沉淀只能是Fe(OH)3,另一种产物为NaOH。
(3)滤液中含有杂质Na2SiO3和NaAlO2,二者都水解显碱性,降低pH有利于两种盐水解产生沉淀,从而除去。
(4)酸化即加酸,CrO42-和H+反应生成Cr2O72-和H2O。
(5)根据发生的反应:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-,可得出关系式:Cr2O72-~3I2~ 6S2O32-,因此样品中所含重铬酸钾的物质的量为 ,重铬酸钾的纯度为
,重铬酸钾的纯度为 。
。
考点:考查化工流程分析,化学方程式书写,中和滴定计算。

下列操作会导致实验结果偏高的是
| A.用天平称量20.5g某物质。砝码和药品的位置放反,所得药品的质量 |
| B.测定Na2CO3溶液的pH时先将pH试纸润湿了再测定,所测得的pH值 |
| C.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度 |
| D.酸式滴定管在盛装标准溶液前没有用标准溶液润洗,测得的待测液浓度 |
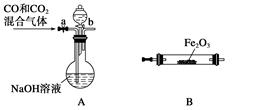
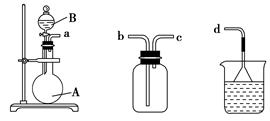
利用反应I2(s)+Cl2(g)=2ICl(l),实验室可用如下图所示装置(加热、夹持仪器已略去)制取少量IC1。
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:
ICl(l)+Cl2(g)=2ICl3(l)
(1)装置A中发生反应的化学方程式是____________。
(2)装置B的作用是______。不能用装置F代替装置E,理由是____________。
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是______ (填标号)。
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |
i.

ii.ICl+KI=I2+KCl
iii.I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将0.500g该油脂样品溶于10mL四氯化碳后,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol?L—1的Na2S2O3,标准溶液滴定。经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL。
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL。
①滴定过程中可用______作指示剂。
②滴定过程中需要不断振荡,否则会导致V1______(填“偏大”或“偏小”)。
③0.500g该油脂样品所消耗的ICl的物质的量为______mol。由此数据经换算即可求得该油脂的不饱和度。

 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。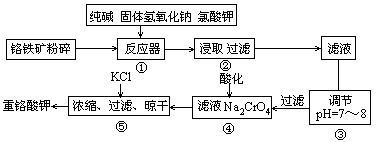
 3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下:
3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,部分实验装置如下: