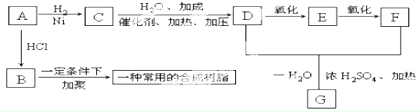
题目内容
水中因含有机物而具有较高的化学耗氧量.常用酸性KMnO4氧化有机物测其含量.主要操作步骤如下(如图1)
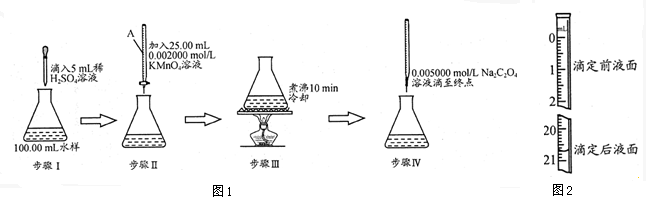
(1)仪器A为 (填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为 .
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42-+ MnO4-+ = Mn2++ CO2↑+
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是 .
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面.
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl-影响
猜想2:配制Na2C2O4标液定容时 .
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl-影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) .
资料卡片:
①有机质可HNO3被氧化.
②AgCl不与酸性KMnO4溶液反应.
③Ag2C2O4可被酸性KMnO4溶液氧化.

(1)仪器A为
(2)完善步骤Ⅳ涉及的离子方程式:
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面.
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl-影响
猜想2:配制Na2C2O4标液定容时
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl-影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液)
资料卡片:
①有机质可HNO3被氧化.
②AgCl不与酸性KMnO4溶液反应.
③Ag2C2O4可被酸性KMnO4溶液氧化.
考点:探究物质的组成或测量物质的含量
专题:有机物的化学性质及推断
分析:(1)依据仪器的结构和用途分析,高锰酸钾溶液滴定到最后一滴溶液呈紫红色且半分钟不褪说明反应达到终点,溶液呈紫红色;
(2)标注元素化合价结合电子守恒和原子守恒配平书写离子方程式,开始较慢,随后反应速率加快说明生成的锰离子起了催化作用;
(3)滴定后为20.70ml,开始为0.70ml,据此标注;
(4)实验测量结果比实际有机物含量偏高,可能是读取数据时把滴定管中消耗溶液体积读大了;
(5)依据资料卡片中的信息分析判断,不能加入氧化性或形成氧化性的物质,不能消耗高锰酸钾溶液;
(2)标注元素化合价结合电子守恒和原子守恒配平书写离子方程式,开始较慢,随后反应速率加快说明生成的锰离子起了催化作用;
(3)滴定后为20.70ml,开始为0.70ml,据此标注;
(4)实验测量结果比实际有机物含量偏高,可能是读取数据时把滴定管中消耗溶液体积读大了;
(5)依据资料卡片中的信息分析判断,不能加入氧化性或形成氧化性的物质,不能消耗高锰酸钾溶液;
解答:
解:(1)仪器A为待玻璃活塞的滴定管为酸式滴定管高锰酸钾溶液滴定到最后一滴溶液呈紫红色且半分钟不褪说明反应达到终点,溶液呈紫红色,步骤Ⅲ中溶液颜色应为紫红色;
故答案为:酸式,紫红色;
(2)碳元素化合价+3价变化为+4价,升高做还原剂,锰元素化合价+7价变化为+2价,C2O42-前加系数5,MnO4-前系数加2,电子守恒、电荷守恒
、原子守恒配平写出离子方程式为:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;
故答案为:5,2,16H+,2,10,8H2O;
(3)滴定后为20.70ml,开始为0.70ml,步骤Ⅳ中所用Na2C2O4溶液为20.00mL,则滴定管读数为:
故答案为: ;
;
(4)实验测量结果比实际有机物含量偏高,配制Na2C2O4标液定容时,可能是读取数据时把滴定管中消耗溶液体积读大了;
故答案为:俯视刻度线;
(5)①有机质可HNO3被氧化.②AgCl不与酸性KMnO4溶液反应.③Ag2C2O4可被酸性KMnO4溶液氧化,
AgNO3溶液在酸性溶液中形成稀硝酸具有氧化性,故不符合;
Ag2SO4溶液,加入后可以利用氯化银溶解度小沉淀转化,消除氯离子影响;
KMnO4溶液具有氧化性,不能消除影响;
Na2C2O4溶液可以被高锰酸钾溶液氧化,不能消除;
消除Cl-影响在步骤Ⅰ的水样中加入适量的Ag2SO4溶液;
故答案为:步骤Ⅰ的水样中加入适量的Ag2SO4溶液;
故答案为:酸式,紫红色;
(2)碳元素化合价+3价变化为+4价,升高做还原剂,锰元素化合价+7价变化为+2价,C2O42-前加系数5,MnO4-前系数加2,电子守恒、电荷守恒
、原子守恒配平写出离子方程式为:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O;
故答案为:5,2,16H+,2,10,8H2O;
(3)滴定后为20.70ml,开始为0.70ml,步骤Ⅳ中所用Na2C2O4溶液为20.00mL,则滴定管读数为:

故答案为:
 ;
;(4)实验测量结果比实际有机物含量偏高,配制Na2C2O4标液定容时,可能是读取数据时把滴定管中消耗溶液体积读大了;
故答案为:俯视刻度线;
(5)①有机质可HNO3被氧化.②AgCl不与酸性KMnO4溶液反应.③Ag2C2O4可被酸性KMnO4溶液氧化,
AgNO3溶液在酸性溶液中形成稀硝酸具有氧化性,故不符合;
Ag2SO4溶液,加入后可以利用氯化银溶解度小沉淀转化,消除氯离子影响;
KMnO4溶液具有氧化性,不能消除影响;
Na2C2O4溶液可以被高锰酸钾溶液氧化,不能消除;
消除Cl-影响在步骤Ⅰ的水样中加入适量的Ag2SO4溶液;
故答案为:步骤Ⅰ的水样中加入适量的Ag2SO4溶液;
点评:本题考查了物质组成的实验探究方法分析,过程理解应用,主要是物质性质的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
1mol 某元素的单质直接与氯气反应后,质量增加7.1g,这种元素是( )
| A、Na | B、Mg | C、Fe | D、Al |
下列物质中,与氢气反应程度最剧烈的是( )
| A、F2 |
| B、Cl2 |
| C、Br2 |
| D、I2 |
下列离子方程式书写正确的是( )
| A、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
| B、稀硫酸和氨水反应:H++NH3?H2O═NH4++H2O |
| C、氢氧化钠和硫酸反应:2OH-+H2SO4═SO42-+2H2O |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+═2Fe3++3Cu |
下列有关FeCl3溶液与Fe(OH)3胶体的叙述正确的是( )
| A、能用丁达尔效应鉴别 |
| B、都是电解质 |
| C、将NaOH溶液加入FeCl3溶液中有红褐色沉淀生成,加入Fe(OH)3胶体则没有沉淀 |
| D、能用过滤的方法分离 |
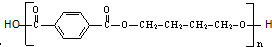 )是一种重要的工程塑料.
)是一种重要的工程塑料.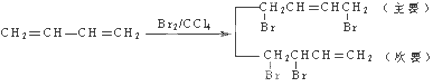
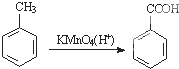
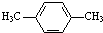 为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH
为原料合成PBT(请用反应流程图表示,并注明反应条件).示例:由乙醇合成聚乙烯的反应流程图可表示为CH3CH2OH 合成PBT的反应流程图为:
合成PBT的反应流程图为: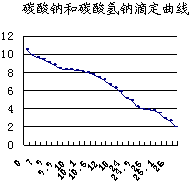 (1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用
(1)滴定法是中学化学一种常见的实验方法,其根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.常用的指示剂有酚酞(变色范围8.2~10.0)和甲基橙(变色范围3.1~4.4).如图为碳酸钠和碳酸氢钠混合溶液滴定曲线(横坐标为加入HCl的量,纵坐标为pH的变化),现以0.1000mol?L-1的盐酸来测定amL某浓度碳酸钠溶液的浓度,可以选用