题目内容
10.下列用水就能鉴别的一组物质是( )| A. | 苯、己烷、四氯化碳 | B. | 苯、乙醇、四氯化碳 | ||
| C. | 乙酸、乙醇、四氯化碳 | D. | 苯、乙醇、乙酸 |
分析 题中涉及物质都为有机物,用水就能鉴别的一组物质,则有机物在水中的溶解性不同、与水的密度不同,产生不同现象则可以鉴别,以此解答该题.
解答 解:A.苯、己烷、四氯化碳都不溶于水,但苯和己烷的密度都小于水,无法鉴别,故A错误;
B.苯和四氯化碳都不溶于水,但苯的密度比水小,四氯化碳的密度比水大,乙醇与水混溶,可鉴别,故B正确;
C.乙酸、乙醇都溶于水,而四氯化碳不溶于水,不能鉴别,故C错误;
D.乙醇、乙酸都溶于水,不能鉴别,故D错误.
故选B.
点评 本题考查有机物的鉴别,题目难度不大,注意把握常见有机物的性质,学习中要加强基础知识的积累,明确密度、溶解性即可解答.

练习册系列答案
相关题目
18.下列实验方案中,可达到预期目的是( )
| A. | 用萃取的方法分离Br2和CCl4混合物 | |
| B. | 加足量烧碱溶液过滤.除去混在镁粉中的少量铝粉 | |
| C. | 加人盐酸酸化的Ba(NO3)2溶液,可以鉴别Na2SO3和Na2SO4 | |
| D. | 用溶解、过滤的方法分离KNO3和NaCl的混合物 |
18.燃烧法是测定有机化合物分子式的一种重要方法.完全燃烧0.1mol 某烃后测得生成的CO2体积为13.44L(标准状况),生成的H2O为12.6g,该烃的同分异构体数目为( )
| A. | 6 | B. | 5 | C. | 4 | D. | 3 |
5.已知丁烷有两种同分异构体,则分子式为C4H8Cl2的有机物共有(不考虑立体异构)( )种.
| A. | 10种 | B. | 9种 | C. | 8种 | D. | 7种 |
2.分子式为C4H10O含羟基的同分异构中,能发生催化氧化的有( )种.
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
19.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水.
已知:过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
完成下列填空:
(1)过程Ⅰ除去的离子是SO42-.
(2)检测Fe3+是否除尽的方法是取少量过程II后的滤液于试管中,滴加几滴KSCN溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽.
(3)过程Ⅰ选用BaCl2而不选用CaCl2,请运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
(4)除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
(5)检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+和Ca2+也沉淀完全.
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

(6)过程Ⅳ除去的离子是NH4+、I-.
(7)过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水.
已知:过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
完成下列填空:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
(2)检测Fe3+是否除尽的方法是取少量过程II后的滤液于试管中,滴加几滴KSCN溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽.
(3)过程Ⅰ选用BaCl2而不选用CaCl2,请运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
(4)除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
(5)检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+和Ca2+也沉淀完全.
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

(6)过程Ⅳ除去的离子是NH4+、I-.
(7)过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
20.物质的量的单位是( )
| A. | 千克 | B. | 摩尔/升 | C. | 摩尔 | D. | 千米 |
 表示的分子式C6H14;若它的一种同分异构体可由一种烯烃加成制得,则此同分异构体的结构体的结构简式为C(CH3)3CH2CH3;若它的一种同分异构体可由所有碳原子在同一平面的烯烃加成制得,该烯烃的结构简式是(CH3)2C=C(CH3)2.
表示的分子式C6H14;若它的一种同分异构体可由一种烯烃加成制得,则此同分异构体的结构体的结构简式为C(CH3)3CH2CH3;若它的一种同分异构体可由所有碳原子在同一平面的烯烃加成制得,该烯烃的结构简式是(CH3)2C=C(CH3)2. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基. 可以被酸性KMnO4溶液氧化,生成
可以被酸性KMnO4溶液氧化,生成 ,但若烷基R中直接与苯环相连的碳原子上没有C-H键,则不容易被氧化到
,但若烷基R中直接与苯环相连的碳原子上没有C-H键,则不容易被氧化到 .现有分子式为C11H16的一烷基取代苯,已知它可以被氧化成为
.现有分子式为C11H16的一烷基取代苯,已知它可以被氧化成为 的异构体共有7种,其中3种是
的异构体共有7种,其中3种是 ,请写出其他4种的结构简式:
,请写出其他4种的结构简式: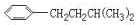 、
、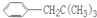 、
、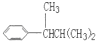 、
、 .
.