题目内容
19.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水.
已知:过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
完成下列填空:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
(2)检测Fe3+是否除尽的方法是取少量过程II后的滤液于试管中,滴加几滴KSCN溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽.
(3)过程Ⅰ选用BaCl2而不选用CaCl2,请运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
(4)除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
(5)检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+和Ca2+也沉淀完全.
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

(6)过程Ⅳ除去的离子是NH4+、I-.
(7)过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
分析 (1)根据氯化钡能够与硫酸根离子反应生成硫酸钡进行解答;
(2)根据检验铁离子的方法进行分析Fe3+是否除尽的方法;
(3)根据表中数据分析BaSO4与CaSO4的溶解度大小,溶解度越小,沉淀越完全;
(4)镁离子能够与碳酸根离子反应生成Mg2(OH)2CO3沉淀,从而除去镁离子杂质,据此写出反应的离子方程式;
(5)根据BaCO3、CaCO3、Mg2(OH)2CO3 的溶解度进行分析;
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,精制盐水先加次氯酸钠,将NH4+氧化成氮气,同时将I-氧化成I2,在盐水a中再加入硫代硫酸钠,将IO3-还原成I2,同时被氧化成硫酸根离子,除去溶液中的I2,得盐水b,通过离子交换法除去Ca2+、Mg2+,得盐水c再电解得氢氧化钠溶液,
(6)次氯酸根离子具有强氧化性,能够氧化铵根离子和碘离子;
(7)根据电解原理及水的电离平衡H2O?H++OH-进行分析在电解槽的阴极区生成NaOH原理.
解答 解:(1)向粗盐水中加入过量BaCl2溶液,硫酸根离子与氯化钡溶液反应生成硫酸钡沉淀,通过过滤除去硫酸钡,从而除去杂质SO42-,
故答案为:SO42-;
(2)检测Fe3+是否除尽的方法为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽,
故答案为:取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽;
(3)硫酸钡的溶度积为2.4×10-4,硫酸钙的溶度积为2.6×10-2,显然硫酸钙的溶度积大于硫酸钡,即BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完,
故答案为:BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完;
(4)镁离子能够与碳酸根离子反应生成难溶物Mg2(OH)2CO3,反应的离子方程式为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑,
故答案为:2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑;
(5)根据步骤数据可知,在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全,
故答案为:在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全;
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,精制盐水先加次氯酸钠,将NH4+氧化成氮气,同时将I-氧化成I2,在盐水a中再加入硫代硫酸钠,将IO3-还原成I2,同时被氧化成硫酸根离子,除去溶液中的I2,得盐水b,通过离子交换法除去Ca2+、Mg2+,得盐水c再电解得氢氧化钠溶液,
(6)过程Ⅳ加入次氯酸钠,次氯酸根离子能够氧化NH4+、I-,从而除去杂质NH4+、I-,
故答案为:NH4+、I-;
(7)电解过程中,H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成,
故答案为:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
点评 本题考查了粗盐的提纯、难溶电解质的沉淀平衡及转化、电解原理、离子方程式的书写等知识,题目难度中等,试题涉及的题量较大,知识点较多,注意掌握粗盐的提纯方法、物质的分离与提纯原则,明确电解原理及应用方法,能够正确书写离子方程式.


(1)请从上图中选用所需的仪器(仪器可重复使用)组成一套验证氯水的酸性、氧化性及漂白性的实验装置,同时证明制氯气过程中产生了O2.现提供以下药品:MnO2、浓硫酸、食盐、石蕊试液、酚酞试液、淀粉-KI溶液、碱石灰、蒸馏水.将所用仪器的序号按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写).
| 选用的仪器 | 加入的试剂 |
| A | 二氧化锰、浓硫酸、食盐 |
| D | -- |
(2)实验持续进行过程中,观察到装有紫色石蕊试液的洗气瓶中的颜色变化是紫色→红色→无色→黄绿色.
(3)实验中观察到装有淀粉-KI溶液的洗气瓶中溶液的颜色由无色变蓝色,最后褪色.经测定碘最终被氧化成+5价,且溶液呈强酸性.写出有关溶液颜色变化的化学反应方程式Cl2+2KI=I2+2KCl,5Cl2+I2+6H2O=2HIO3+10HCl.
| A. | 苯、己烷、四氯化碳 | B. | 苯、乙醇、四氯化碳 | ||
| C. | 乙酸、乙醇、四氯化碳 | D. | 苯、乙醇、乙酸 |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
| A. | CH2═CH-CH2-CH3 | B. |  | C. |  | D. |  |
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 |
| A. | 氧化反应 | B. | 加成反应 | C. | 酯化反应 | D. | 水解反应 |
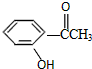 ②:
②: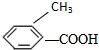
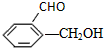 ④
④ ⑤
⑤
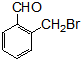 .
.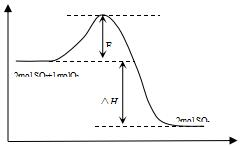 2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.
2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.