题目内容
2.下列反应属于可逆反应的是( )| A. | 电解水生成H2、O2与H2在O2中燃烧生成H2O | |
| B. | H2和I2在高温下边化合边分解 | |
| C. | 溶解与结晶 | |
| D. | SO2通入品红溶液褪色,加热后又恢复红色 |
分析 可逆反应是指在同一条件下,既能向生成物方向进行,同时又能向反应物方向进行的反应.注意条件相同,同时向正逆两个方向进行.
解答 解:A、可逆反应要求正、逆反应在同一条件下进行,电解水生成H2和O2的反应是在通电条件下进行的,而H2与O2燃烧生成H2O的反应是在点燃条件下进行的,条件不同,不是可逆反应,故A错误;
B、H2和I2的生成和分解为相同条件下同时进行的两个反应,故B正确;
C、溶解与结晶过程没有发生化学变化,不是可逆反应,故C错误;
D、SO2使品红溶液褪色,加热又复原,是不同条件下进行的两个过程,故不是可逆反应,故D错误.
故选B.
点评 本题主要考查可逆反应概念,难度较小,注意把握可逆反应条件相同,同时向正逆两个方向进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
13.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液与过量的氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 钠和硫酸铜溶液的反应:2Na+Cu2+═2Na++Cu | |
| C. | 铜与浓硝酸反应:Cu+NO3-+4H+═Cu2++NO2↑+2H2O | |
| D. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO |
10.学习化学反应速率时,我们可以用物理上的速率知识来大胆类推学习,二者在许多方面都是极其相似的.下列关于化学反应速率的说法中,不正确的是( )
| A. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| C. | 在同一个反应中,用各物质表示的反应速率之比等于其化学方程式中的化学计量数之比 | |
| D. | 化学反应速率的常用单位有mol•L-1•s-1和mol/(L•min) |
14.化学与工农业生产和人类生活密切相关.下列说法中,不正确的是( )
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 油脂在碱性条件下水解可制得肥皂 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀 | |
| D. | 使用太阳能等代替化石燃料,符合低碳节能减排的要求 |
11.铁及碳的化合物在社会生产、生活中有着广泛的应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+4C(s)?3Fe(s)+4CO(g)△H=+646.0kJ•mol-1
②C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
①从表中数据可推断,该反应是吸热(填“放热”或“吸热”)反应.
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是BD(填字母).
A.c(CO2)=c(CO) B.v正(CO2)=v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)?CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
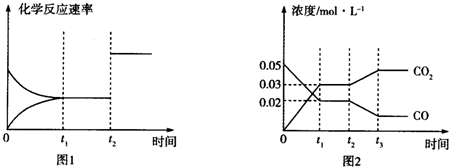
①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=0.006mol•L-1•s-1.
②图1中t2时刻改变的条件是加入催化剂或增大压强(任写两种,下同);图2中t2时刻改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为CO+CO32--2e-=2CO2;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为6.72L
(标准状况下).
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+4C(s)?3Fe(s)+4CO(g)△H=+646.0kJ•mol-1
②C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
| 温度/K | 973 | 1173 | 1373 | 1573 |
| K | 1.47 | 2.15 | 3.36 | 8.92 |
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是BD(填字母).
A.c(CO2)=c(CO) B.v正(CO2)=v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)?CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:

①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=0.006mol•L-1•s-1.
②图1中t2时刻改变的条件是加入催化剂或增大压强(任写两种,下同);图2中t2时刻改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为CO+CO32--2e-=2CO2;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为6.72L
(标准状况下).
4.下列实验中,所采取的实验方法(或操作)与对应的原理都正确的是( )
| 选项 | 实验 | 方法(或操作) | 原理 |
| A | 分离溶于水中的溴 | 裂解汽油萃取 | 碘在裂解汽油中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 从蛋清中提取蛋白质 | 加入硫酸铜溶液 | 浓盐溶液使蛋白质溶解度降低 |
| D | 尿液中尿糖的检验 | 加入新制Cu(OH)2、加热 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |