题目内容
14.下列含有共价键的化合物是( )| A. | H2O | B. | Br2 | C. | NaOH | D. | NaCl |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,只含共价键的化合物为共价化合物,离子化合物中一定含有离子键,可能含有共价键.
解答 解:A.H2O中只含有H-O共价键,属于共价化合物,故A正确;
B.溴原子之间存在非极性共价键,但溴为单质不是化合物,故B错误;
C.氢氧化钠中钠离子和氢氧根离子之间存在离子键,氢氧根离子中氧原子和氢原子之间存在极性共价键,故C正确;
D.氯化钠中只含离子键,为离子化合物,故D错误;
故选AC.
点评 本题考查了离子键、共价键、离子化合物、共价化合物的区别与联系,侧重考查学生对概念的辨别能力,属于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
4.下列物质的水溶液显酸性的是( )
| A. | 乙醇 | B. | 乙醛 | C. | 乙酸 | D. | 乙酸乙酯 |
5.下列有关Na2CO3和NaHCO3的说法中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 相同温度下在水中的溶解度:Na2CO3<NaHCO3 | |
| C. | 取1 mol•L-1的两种溶液,分别滴加澄清石灰水,有沉淀生成的是Na2CO3溶液 | |
| D. | 取等质量的两种固体分别与等浓度等体积的盐酸反应,生成气泡较快的是NaHCO3溶液 |
2.下列实验能说明SO2具有漂白作用的是( )
①SO2气体能使溴水褪色
②SO2能使酸性高锰酸钾溶液褪色
③SO2气体能使品红溶液褪色
④SO2气体能使黄色的草帽变白色.
①SO2气体能使溴水褪色
②SO2能使酸性高锰酸钾溶液褪色
③SO2气体能使品红溶液褪色
④SO2气体能使黄色的草帽变白色.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
9.碳碳双键不能自由转动,所以R-CH=CH-R′(R、R′为烃基)可有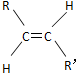 和
和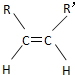 两种空间形式(同分异构体),判断下列化合物中具有上述两种空间排列形式的是( )
两种空间形式(同分异构体),判断下列化合物中具有上述两种空间排列形式的是( )
 和
和 两种空间形式(同分异构体),判断下列化合物中具有上述两种空间排列形式的是( )
两种空间形式(同分异构体),判断下列化合物中具有上述两种空间排列形式的是( )| A. | 乙烯 | B. | 2-戊烯 | C. | 苯乙烯 | D. | 乙烷 |
19.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2 L的乙炔中所含的共用电子对数为1.5NA | |
| B. | 16g甲烷所含电子数目为16NA | |
| C. | 标准状况下,11.2 L三氯甲烷所含分子数为0.5NA | |
| D. | 14 g乙烯的原子数为3NA |
6.某元素原子的原子核外有三个电子层,K层电子数为a,L层电子数为b,M层电子数为b-a,该原子核内的质子数是( )
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
3.下列表达式中不正确的是( )
| A. | S2-的电子排布式为1s22s22p63s23p6 | |
| B. | 26号元素的电子排布式为[Ar]3d64s2 | |
| C. | 基态C原子的轨道表示式为  | |
| D. | 基态N原子的轨道表示式为  |
 醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.
醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.