题目内容
反应:2SO2(g)+O2(g)?2SO3(g)(每生成2molSO3放出QKJ热量).在相同温度条件下,向一密闭恒容容器中通入2molSO2和1molO2达平衡时放出的热量为Q1,向另一容积相同的恒容密闭容器中通入1molSO2和0.5molO2达平衡时,放出的热量为Q2,则Q1、Q2满足的关系是( )
A、Q2=
| ||
B、Q2<
| ||
| C、Q2<Q1=Q | ||
| D、Q1=Q2<Q |
考点:有关反应热的计算,反应热的大小比较
专题:化学反应中的能量变化
分析:可逆反应是不能进行到底的反应,即反应后的体系中含有所有反应物和生成物;2SO2(g)+O2(g)?2SO3(g)为气体体积缩小反应,减平衡向逆方向移动,据此解答.
解答:
解:反应:2SO2(g)+O2(g)?2SO3(g)(每生成2molSO3放出QKJ热量),该反应为可逆反应,所以向一密闭恒容容器中通入2molSO2和1molO2达平衡生成的三氧化硫小于2mol,反应放出的热量Q1<Q;
向另一容积相同的恒容密闭容器中通入1molSO2和0.5molO2达平衡时,如果不考虑平衡的移动,放出的热量应为Q2=
,但是在密闭恒容容器中2SO2(g)+O2(g)?2SO3(g),向一密闭恒容容器中通入2molSO2和1molO2与通入1molSO2和0.5molO2相比,相当于增大了容器的压强,平衡向正方向移动,所以转化率高于通入1molSO2和0.5molO2相转化率,放出的热量应大于2Q2,所以Q2<
,
故选B.
向另一容积相同的恒容密闭容器中通入1molSO2和0.5molO2达平衡时,如果不考虑平衡的移动,放出的热量应为Q2=
| Q1 |
| 2 |
| Q1 |
| 2 |
故选B.
点评:本题考查了可逆反应的特点,并把可逆反应与反应热结合起来,增大了题目的难度,解题时注意把握可逆反应的特点和化学平衡移动的规律,注意培养分析问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验所用装置正确的是( )

| A、用甲图装置制备气体实现“随开随制,随关随停” |
| B、用乙图装置制取乙炔 |
| C、用丙图装置制备氢氧化亚铁 |
| D、用丁图装置制取乙烯 |
对下列实验过程的评价,正确的是( )
| A、往某溶液中先加稀硝酸,再加入AgNO3溶液,有白色沉淀,证明溶液中一定含Cl- |
| B、某溶液中先滴加BaCl2溶液,再加盐酸,生成白色沉淀,证明溶液中一定含有SO42- |
| C、某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| D、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
下列实验操作与安全事故处理正确的是( )
| A、做H2还原CuO的实验时,为防止H2爆炸,实验完毕,应先停止通H2,再停止加热 | ||
| B、配制稀硫酸溶液时,先在量筒加入一定体积的水,再沿容器壁慢慢加入浓硫酸,并不断搅拌 | ||
C、用试管夹从试管底由下往上夹住距离管口约
| ||
| D、分液漏斗在使用前要检漏,使用过程中要适当旋开活塞放气 |
下列食物中属于酸性食物的是( )
| A、豆腐 | B、柠檬酸 | C、鸡蛋 | D、黄瓜 |
下列离子方程式书写正确的是( )
| A、食醋除水垢中的碳酸钙 CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | ||
| B、等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+CO32- | ||
| C、将磁性氧化铁溶于盐酸:Fe3O4+8H+=Fe3++4H2O | ||
D、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
|
根据化学反应的实质是旧键断裂、新键形成这一观点,下列变化属于化学反应的是( )
| A、碘升华 |
| B、NaCl的晶体加热熔化 |
| C、加热NH4HCO3分解 |
| D、HCl溶于水 |
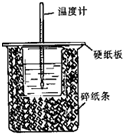 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液,在如右图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液,在如右图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: