题目内容
12.化学知识在生产和生活中有着重要的应用.下列说法中正确的是( )| A. | 明矾常作为消毒剂 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 高纯度的硅单质广泛用于制作光导纤维 | |
| D. | 钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等 |
分析 A.明矾常用作净水剂;
B.水晶成分为二氧化硅,不属于硅酸盐制品;
C.二氧化硅广泛用于制作光导纤维;
D.金属钠具有还原性,可以用于冶炼金属.
解答 解:A.明矾不具有氧化性,不能作常用作消毒剂,铝离子水解生成的氢氧化铝具有净水作用,所以明矾可以做净水剂,故A错误;
B.水晶的主要成分是二氧化硅,含有硅元素,但不是硅酸盐,餐桌上的瓷盘是硅酸盐制品,故B错误;
C.二氧化硅广泛用于制作光导纤维,单质硅用作半导体材料,故C错误;
D.金属钠具有还原性,可以用于冶炼金属钛、钽、铌、锆等,故D正确;
故选D.
点评 本题考查常见物质的性质以及应用,题目难度不大,明确常见物质组成、性质及用途是解题的关键,试题培养了学生灵活运用基础知识的能力.

练习册系列答案
相关题目
20.已知下列热化学方程式:
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8kJ/mol
则氢气的燃烧热为( )
2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8kJ/mol
则氢气的燃烧热为( )
| A. | 438.6 kJ/mol | B. | 241.8 kJ/mol | C. | 285.8kJ/mol | D. | -285.8 kJ/mol |
7.NA代表阿伏加德罗常数,则关于热化学方程C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1300kJ•mol-1的说法中,正确的是( )
| A. | 有10NA个电子转移时,放出1300kJ的能量 | |
| B. | 有44.8LCO2气体生成时,放出1300kJ的能量 | |
| C. | 有NA个水分子生成且为液体时,吸收1300kJ的能量 | |
| D. | 有4NA个碳氧共用电子对生成时,放出1300kJ的能量 |
1.实验室里用下列仪器和药品来制取纯净的无水氯化铜:
图中A、B、C、D、E、F的虚线部分表示玻璃管接口,接口的弯曲和伸长等部分未画出.根据要求填写下列各小题空白.
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接④接②接①接⑥.
(2)实验开始时,应首先检查该装置的检验装置气密性;实验结束时,应先熄灭①处的酒精灯.
(3)待充分反应后,装置①的玻璃管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿(或蓝绿)色.
(4)装置④的作用是除去氯气中的氯化氢;装置⑥中的现象是红色逐渐褪去,发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 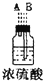 | 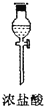 |  | 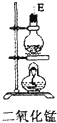 | 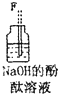 |
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接④接②接①接⑥.
(2)实验开始时,应首先检查该装置的检验装置气密性;实验结束时,应先熄灭①处的酒精灯.
(3)待充分反应后,装置①的玻璃管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿(或蓝绿)色.
(4)装置④的作用是除去氯气中的氯化氢;装置⑥中的现象是红色逐渐褪去,发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
5. 已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )
 已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )| A. | T1<T2 P1>P2 m+n<P Q<0 | B. | T1>T2 P1<P2 m+n>P Q>0 | ||
| C. | T1<T2 P1<P2 m+n<P Q>0 | D. | T1>T2 P1<P2 m+n>P Q<0 |

