题目内容
10.根据反应8NH3+3Cl2→6NH4Cl+N2,回答下列问题:(1)该反应中氧化剂是Cl2,氧化产物是N2.
(2)该反应中被氧化的物质与被还原的物质物质的量之比为2:3.
(3)用单线桥法标出电子转移的方向与数目.
分析 该反应中N元素化合价由-3价变为0价,化合价升高被氧化、Cl元素化合价由0价变为-1价,化合价降低被还原,所以NH3是还原剂、Cl2是氧化剂,结合元素化合价的变化解答该题.
解答 解:(1)8NH3+3Cl2=6NH4Cl+N2,反应中N元素化合价由-3价变为0价,化合价升高被氧化,Cl元素化合价由0价变为-1价,化合价降低被还原,所以NH3是还原剂、Cl2是氧化剂,生成的氮气为氧化产物,故答案为:Cl2;N2;
(2)该中2molN元素化合价由-3价变为0价被氧化、3mol氯元素化合价由0价变为-1价被还原,所以被氧化的物质与被还原的物质物质的量之比为2:3,
故答案为:2:3;
(3)反应中N元素的化合价由-3升高为0,Cl元素的化合价0降低为-1价,2molNH3作还原剂转移电子为6mol,则反应电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
点评 本题考查氧化还原反应的计算,为高考高频考点,把握发生的化学反应及反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
20.针对下面几种元素,完成以下各小题.
(1)C、N、O、Si四种元素电负性从小到大排列?硅<碳<氮<氧(填名称).
(2)Na、Mg、Al三种元素第一电离能从大到小排列?Mg>Al>Na(填符号).
(3)Al的电子排布式为?1s22s22p63s23p1?.N的外围电子排布式?2s22p3.
(4)S和O的氢化物相比,沸点较高的是?H2O?(填化学式),原因是?水分子之间存在氢键.
(5)干冰的电子式为? ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出其逆反应的热化学方程式:?2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1.(其中N≡N键、N-H键、H-H的键能分别为946kJ•mol-1、391kJ•mol-1、436kJ•mol-1)
(7)26号元素的外围电子排布式为?3d64s2,其+3价阳离子的外围电子的轨道表示式为? .
.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)Na、Mg、Al三种元素第一电离能从大到小排列?Mg>Al>Na(填符号).
(3)Al的电子排布式为?1s22s22p63s23p1?.N的外围电子排布式?2s22p3.
(4)S和O的氢化物相比,沸点较高的是?H2O?(填化学式),原因是?水分子之间存在氢键.
(5)干冰的电子式为?
 ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出其逆反应的热化学方程式:?2NH3(g)?N2(g)+3H2(g)△H=+92kJ•mol-1.(其中N≡N键、N-H键、H-H的键能分别为946kJ•mol-1、391kJ•mol-1、436kJ•mol-1)
(7)26号元素的外围电子排布式为?3d64s2,其+3价阳离子的外围电子的轨道表示式为?
 .
.
18.以下列分子式所表示的物质一定是纯净物的是( )
| A. | C2H5Cl | B. | C4H8 | C. | C6H6 | D. | C3H6O |
5.可用一种试剂鉴别KCl、Ba(OH)2、Na2CO3、K2SO3四种溶液,该试剂是( )
| A. | BaCl2 | B. | H2SO4 | C. | KOH | D. | HCl |
15.下列反应的离子方程式正确的是( )
| A. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 苯酚钠溶液中通入少量的CO2:2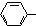 O-+CO2+H2O→2 O-+CO2+H2O→2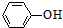 +CO32- +CO32- | |
| C. | 乙醛与新制的氢氧化铜悬浊液:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 氯乙酸与足量氢氧化钠溶液共热:ClCH2COOH+OH- $\stackrel{△}{→}$ ClCH2COO-+H2O |
2.下列反应为吸热反应的是( )
| A. | 铝片与盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | NaOH与HCl反应 | D. | 食物的缓慢氧化 |
8.以下说法错误的是( )
| A. | 银氨溶液可用于区分麦芽糖和葡萄糖 | |
| B. | 乙烷、乙醛、乙酸的沸点逐渐升高 | |
| C. | 1mol乙酰水杨酸(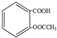 )最多可以和3molNaOH反应 )最多可以和3molNaOH反应 | |
| D. | 邻甲基苯酚(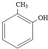 )可以和HCHO发生缩聚反应 )可以和HCHO发生缩聚反应 |