��Ŀ����
����Ŀ��������һ������Ч��������Դ����ξ���ʵ�õ���ȡ������Ϊ��Ҫ���⡣
(1)���ѭ���ֽ�ˮ��һ�ָ�Ч�����������ⷽ����������ͼ���£�
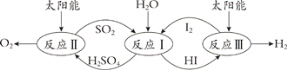
��֪��
��ӦI��SO2(g) + I2(g) + 2H2O(l) = 2HI(aq) + H2SO4(aq) ��H1=��213 kJ��mol-1
��ӦII��H2SO4(aq) = SO2(g) + H2O(l) +1/2O2(g) ��H2= +327 kJ��mol-1
��ӦIII��2HI(aq) = H2(g) + I2(g) ��H3= +172 kJ��mol-1
��Ӧ2H2O(l) = 2H2(g)+O2(g) ��H= ________��
(2)H2S�����ڸ�Ч��ȡ�����������ķ�ӦΪ2H2S(g)S2(g)��2H2(g)��
��.����ʼʱ������ֻ��H2S��ƽ��ʱ�������ʵ����ʵ������ѽ��¶ȵĹ�ϵ��ͼ��
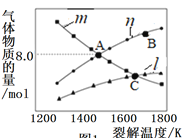
��ͼ������1��ʾ��������________________(�ѧʽ)��
��A��ʱH2S��ת����Ϊ__________________��
��C��ʱ���������ڵ���ѹΪpPa����ƽ�ⳣ��Kp=________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)��
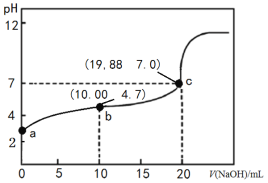
II.��������������ĺ��������зֱ����2.0mol H2S��1.0mol H2S����ò�ͬ�¶���H2S��ƽ��ת������ͼ��ʾ��
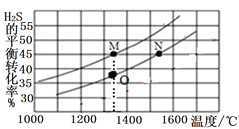
��M���O����淴Ӧ����v(M)______v(O) (����>����<������=������ͬ)��
��M��N���������ڵ�ѹǿ2P(M)_____P(N)��ƽ�ⳣ��K(M)_____K(N)��
���𰸡���572kJ��mol��1 S2 50% p Pa < < <
��������
(1)���ø�˹���ɽ��з�Ӧ2H2O(l) = 2H2(g)+O2(g) ��H�ļ��㣻
(2)��.�ɷ�Ӧ����ʽ2H2S(g)![]() S2(g)+2H2(g)��֪������ʼʱ������ֻ��H2S��ƽ��ʱS2�����ʵ���ΪH2��
S2(g)+2H2(g)��֪������ʼʱ������ֻ��H2S��ƽ��ʱS2�����ʵ���ΪH2��![]() ��������l��ʾ��������S2������m��ʾ��������H2S������n��ʾ��������H2���ݴ˷������
��������l��ʾ��������S2������m��ʾ��������H2S������n��ʾ��������H2���ݴ˷������
��.��Ӧ2H2S(g)![]() S2(g)+2H2(g)�У�H2S�����ʵ������ӣ���ƽ��ת���ʷ�����С����M���O��ֱ����ڵ����ߴ���H2S����ʼ��Ϊ0.1mol��0.2mol���ݴ˽��
S2(g)+2H2(g)�У�H2S�����ʵ������ӣ���ƽ��ת���ʷ�����С����M���O��ֱ����ڵ����ߴ���H2S����ʼ��Ϊ0.1mol��0.2mol���ݴ˽��
(1)���ݸ�˹���ɣ���Ӧ(��+��+��)��2�ɵõ���Ӧ2H2O(l) = 2H2(g)+O2(g)������H=2(��H1+��H2+��H3)=2��(172+327-213)=+572kJ��mol-1���ʴ�Ϊ��+572kJ��mol-1��
(2)��.���ɷ�Ӧ����ʽ2H2S(g)![]() S2(g)+2H2(g)��֪������ʼʱ������ֻ��H2S��ƽ��ʱS2�����ʵ���ΪH2��
S2(g)+2H2(g)��֪������ʼʱ������ֻ��H2S��ƽ��ʱS2�����ʵ���ΪH2��![]() ��������l��ʾ��������S2���ʴ�Ϊ��S2��
��������l��ʾ��������S2���ʴ�Ϊ��S2��
�ڸ���ͼ��A��ʱ����������������ʵ�����ȣ�����2H2S(g)![]() S2(g)+2H2(g)��˵����Ӧ��������ʣ���������ȣ�H2S��ת����Ϊ50%���ʴ�Ϊ��50%��
S2(g)+2H2(g)��˵����Ӧ��������ʣ���������ȣ�H2S��ת����Ϊ50%���ʴ�Ϊ��50%��
�۸���A���֪����ʼʱ����Ϊ20mol��B��ʱ��������S2�����ʵ�����ȣ���ֽ������Ϊx����20-x=![]() �����x=
�����x=![]() mol���������H2S
mol���������H2S![]() mol��S2
mol��S2![]() mol��H2
mol��H2![]() mol�����ʵ��������ֱ�Ϊ
mol�����ʵ��������ֱ�Ϊ![]() ��
��![]() ��
��![]() ��ƽ�ⳣ��Kp=
��ƽ�ⳣ��Kp= ���ʴ�Ϊ��p Pa��
���ʴ�Ϊ��p Pa��
��.�ٷ�Ӧ2H2S(g)![]() S2(g)+2H2(g)�У�H2S�����ʵ������ӣ���ƽ��ת���ʷ�����С����M���O��ֱ����ڵ����ߴ���H2S����ʼ��Ϊ0.1mol��0.2mol�����������У�M���Ũ��С��O�㣬���淴Ӧ����v(M)< v(O)���ʴ�Ϊ��<��
S2(g)+2H2(g)�У�H2S�����ʵ������ӣ���ƽ��ת���ʷ�����С����M���O��ֱ����ڵ����ߴ���H2S����ʼ��Ϊ0.1mol��0.2mol�����������У�M���Ũ��С��O�㣬���淴Ӧ����v(M)< v(O)���ʴ�Ϊ��<��
����ͼ���֪��H2S��ת���ʾ�Ϊ45%����������ʽ�У�

n(��)N=1.1+0.45+0.9=2.45mol

n(��)M=0.55+0.45+0.225=1.225mol
2n(��)M=n(��)M����ͼ���֪TM<TN����PV=nRT�ɵã�2P(M)<P(N)�� ��
�� ����K(M)<K(N)���ʴ�Ϊ��<��<��
����K(M)<K(N)���ʴ�Ϊ��<��<��

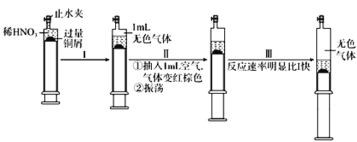
����Ŀ��ijʵ��С��Ϊ��̽��SO2�����ʣ����������װ�ã�

ʵ�鲽�裺
�������Ӻ�װ�ã���������ԣ��ټ����Լ���
������A�Թ���
����ͭ˿���ϳ鶯�뿪Һ�档
��1��A�Թ��з�����Ӧ�Ļ�ѧ����ʽ��______��
��2��B�Թ��е�������______��
��3���Թ�C����������ijС��ȡһ���ַ�Ӧ�����Һ���ֱ�μ������Լ�������Ԥ���ܷ����ɳ����������ɳ�����д�����ɳ����Ļ�ѧʽ��
�����Լ� | �ܷ����ɳ��� | �����Ļ�ѧʽ |
��ˮ | _____________ | __________ |
��ˮ | __________ | ___________ |
����Ŀ�����и�������֮�䲻����ʵ����ͼ��ʾת�����ǣ� ��
![]()
ѡ�� | X | Y | Z | M |
A | S | SO2 | SO3 | O2 |
B | HNO3 | Fe(NO3)3 | Fe(NO3)2 | Fe |
C | NaOH | Na2CO3 | Na2CO3 | CO2 |
D | HN3 | NO | NO2 | O2 |
A. A B. B C. C D. D