题目内容
C《有机化学》
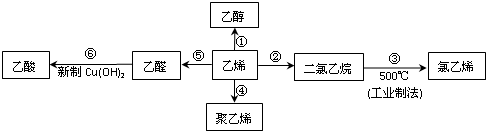
乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):
按下列要求写出:
(1)聚乙烯的结构简式是 .乙酸中所含官能团的名称为 基.
(2)乙醇能与乙酸反应生成有果香味的物质,其名称为 ,该反应类型是 .
(3)反应②的化学方程式是 ,反应类型是 .
(4)反应⑥的化学方程式是 ,实验现象是 .
乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):

按下列要求写出:
(1)聚乙烯的结构简式是
(2)乙醇能与乙酸反应生成有果香味的物质,其名称为
(3)反应②的化学方程式是
(4)反应⑥的化学方程式是
考点:有机物的结构和性质,有机物的合成
专题:有机物的化学性质及推断
分析:反应①是乙烯与水发生加成反应生成乙醇,反应②是乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应③是1,2-二氯乙烷发生消去反反应生成氯乙烯与HCl,反应④是乙烯发生加聚反应生成聚乙烯,反应⑤是乙烯与氧气在催化剂条件下发生氧化反应生成乙醛,反应⑥是乙醛与新制氢氧化铜发生氧化反应生成乙酸.
解答:
解:反应①是乙烯与水发生加成反应生成乙醇,反应②是乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应③是1,2-二氯乙烷发生消去反反应生成氯乙烯与HCl,反应④是乙烯发生加聚反应生成聚乙烯,反应⑤是乙烯与氧气在催化剂条件下发生氧化反应生成乙醛,反应⑥是乙醛与新制氢氧化铜发生氧化反应生成乙酸,
(1)CH2=CH2含有碳碳双键,发生加聚反应生成聚乙烯,聚乙烯的结构简式为 ,乙酸中的官能团为-COOH,名称为羧基,
,乙酸中的官能团为-COOH,名称为羧基,
故答案为: ;羧;
;羧;
(2)乙酸与乙醇在浓硫酸作用下、加热发生反应:CH3COOH+C2H5OH
CH3COOC2H5+H2O,生成有果香味的物质为乙酸乙酯,该反应是酯化反应,也属于取代反应,故答案为:乙酸乙酯;酯化反应(或取代反应);
(3)反应②是乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应方程式为:CH2=CH2+Cl2→ClCH2-CH2Cl,故答案为:CH2=CH2+Cl2→ClCH2-CH2Cl;加成反应;
(4)在加热条件下,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水,氧化亚铜为砖红色沉淀,反应方程式为:CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O,
故答案为:CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O;出现砖红色沉淀.
(1)CH2=CH2含有碳碳双键,发生加聚反应生成聚乙烯,聚乙烯的结构简式为
 ,乙酸中的官能团为-COOH,名称为羧基,
,乙酸中的官能团为-COOH,名称为羧基,故答案为:
 ;羧;
;羧;(2)乙酸与乙醇在浓硫酸作用下、加热发生反应:CH3COOH+C2H5OH
| 浓硫酸 |
| △ |
(3)反应②是乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应方程式为:CH2=CH2+Cl2→ClCH2-CH2Cl,故答案为:CH2=CH2+Cl2→ClCH2-CH2Cl;加成反应;
(4)在加热条件下,乙醛和新制氢氧化铜发生氧化还原反应生成乙酸、氧化亚铜和水,氧化亚铜为砖红色沉淀,反应方程式为:CH3CHO+2Cu(OH)2
| △ |
故答案为:CH3CHO+2Cu(OH)2
| △ |
点评:本题考查有机物的性质、有机反应类型、有机反应方程式书写等,注意根据名称判断发生的反应,有利于基础知识的巩固.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
在4NH4+5O2?4NO+6H2O反应中,表示该反应速率最快的是( )
| A、υ(NH4)=0.8 mol/(L?s) |
| B、υ(O2)=1.0 mol/(L?s) |
| C、υ(NO)=1.0 mol/(L?s) |
| D、υ(H2O)=1.8 mol/(L?s) |
下列分散系中,属于胶体的是( )
| A、石灰水 | B、三氯化铁溶液 |
| C、蛋白质溶液 | D、稀硫酸 |
下列有关化学实验的叙述正确的是( )
| A、用带玻璃塞的试剂瓶保存Na2CO3溶液 |
| B、配制FeCl3溶液时,向溶液中加入少量铁粉和稀盐酸 |
| C、在铁件表面镀铜时,用铁件作阴极、铜作阳极、稀硫酸作电镀液 |
| D、实验室进行肥皂反应时,在油脂和氢氧化钠的混合液中加入适量酒精 |